. Wstęp
Złotowiciowce (Chrysophyceae i Synurophyceae) to organizmy występujące we wszystkich typach wód i różnych strefach klimatycznych, które jednakże preferują zacienione, lekko humusowe wody stojące (stawy, jeziora). Ważnymi czynnikami warunkującymi ich występowanie jest pH, zawartość składników odżywczych i zasolenie wody. Mają również różne wymagania temperaturowe co wiąże się z sezonowością ich występowania, dlatego bywają okresy letnie, kiedy złotowiciowców jest bardzo mało, lub nie ma ich wcale. Poza tym ich cechą rozpoznawalną jest zdolność wytwarzania form spoczynkowych, zwanych stomatocystami, które umożliwiają przetrwanie niekorzystnych warunków środowiskowych (Kristiansen & Preisig, 2007).
Stomatocysty to małe, mierzące zwykle od 2 do 30 µm średnicy formy przetrwalnikowe złotowiciowców. Cechuje je charakterystyczna dla danego morfotypu wielkość, kształt, typ otworu, kształt kołnierzyka oraz typ ornamentacji. Klasyfikowane są niezależnie od form wegetatywnych, które je wytwarzają i mają własny, odrębny system taksonomiczny (Duff et al., 1995; Wilkinson et al., 2001).
Niniejszy artykuł jest jedną z kilku prac, w których przedstawione zostały wyniki badań nad krzemionkowymi formami przetrwalnikowymi złotowiciowców występujących w różnych siedliskach Tatrzańskiego Parku Narodowego (TPN). Celem pracy było opisanie i udokumentowanie występowania stomatocyst w nienazwanym zagłębieniu wytopiskowym w Dolinie Suchej Wody (ZW), określenie podstawowych parametrów fizyko-chemicznych wody i zbadanie korelacji między cechami morfologicznymi, a występowaniem stomatocyst w różnych mikrosiedliskach.
. Materiał i metody
Charakterystyka stanowisk badawczych
Materiał pobrano z nienazwanego zagłębienia wytopiskowego, okresowo wypełnionego wodą, w Dolnie Suchej Wody (ZW), w Tatrzańskim Parku Narodowym. Zagłębienie wytopiskowe, w którym prowadzono badania leży między Stawem Toporowym Wyżnim, a Stawem Toporowym Niżnim, nieco na wschód. Jest ono oznaczone numerem 12 w pracy Derkacz (2006), a jego współrzędne geograficzne wynoszą: 49°16′50″N, 20°01′55″E. Wyprawy badawcze do tego stanowiska organizowane były trzy razy. Pierwszy raz w kwietniu 2003 roku, następnie dwa razy w 2004 roku. Podczas dwóch pierwszych wizyt zagłębienie było wyschnięte, natomiast w czasie ostatniej wizyty, 8 sierpnia 2004 roku, zagłębienie wypełnione było wodą na głębokość około 1 m. Właśnie wtedy pobrano próby do badań i przeprowadzono analizy fizyko-chemiczne wody dla toni wodnej. Próby pobrano z czterech różnych mikrosiedlisk: (1) z powierzchni wody, (2) z toni wodnej, (3) osady z dna jeziora oraz (4) z wody wyciśniętej z mchów i Vaucheriaspp., które porastały dno stawu. W sumie pobrano osiem próbek, po dwie z każdego mikrosiedliska. Próby z powierzchni wody i z toni wodnej pobierano siatką planktonową, próby z dna za pomocą pompki, a rośliny wyciskano ręcznie.
Analiza fizyko-chemiczna wody
Podstawowe właściwości fizyko-chemiczne wody badano 8 sierpnia 2004, przy użyciu Aquamerck® Compact Laboratory for Water Testing (Merck) i przeprowadzono je dla toni wodnej. Zbadano pH (6,0), temperaturę wody (13 °C) i zawartość tlenu w wodzie (6,9 mg/l).
Przygotowanie próbek
Próby pobierano do szklanych, sterylnych fiolek. W laboratorium każdą z nich dzielono na dwie części. Jedną konserwowano płynem Lugola, drugą zalewano 10% HCl, w celu usunięcia węglanów, po czym odstawiano na 24 godz. Potem gotowano przez 15 min. i kilkakrotnie płukano wodą destylowaną. W kolejnym etapie próbki zalewano 30% H2O2 i odstawiano na 24 godz., po czym gotowano je przez 30 min. z niewielka ilością KClO3, a następnie ponownie płukano wodą destylowaną. Na koniec próby zalano 95% etanolem.
W celu przeprowadzenia analiz w elektronowym mikroskopie skaningowym (SEM), niewielką część każdej próby nakładano na szkiełko, suszono na powietrzu. Tak przygotowany preparat przyklejano na metalową podstawkę (holder). Z każdej próby sporządzono po dwie podstawki. Próby następnie napylano złotem przy użyciu napylarki CRESSINGTON i analizowano z wykorzystaniem mikroskopu Hitachi S-4700. W tak przygotowanym materiale prowadzono analizy stomatocyst, badano ich zależności liczbowe przeglądając całe podstawki pasek po pasku. Analizy te wykonano w Laboratorium Mikroskopii Elektronowej Skaningowej i Mikroanalizy UJ. Wszystkie zidentyfikowane stomatocysty zostały zmierzone i oznaczone zgodnie z wytycznymi ustalonymi przez International Statospore Working Group (ISWG) guidelines (Cronberg & Sandgren, 1986).
. Wyniki
W próbach z zagłębienia wytopiskowego stwierdzono występowanie 92 okazów stomatocyst. W sumie, wśród nich zidentyfikowano 26 różnych morfotypów. Szesnaście z nich okazało się nowymi dla TPN (10, Cabała J. in Wołowski et al., 2004; 136 forma A, Duff & Soml in Duff et al., 1992 emend.Gilbert & Smol in Gilbert et al., 1997; 171, Zeeb & Smol, 1993; 196, Duff & Smol, 1994 emend. Wilkinson & Smol in Wilkinson et al., 2001; 211, Duff & Smol, 1994; 260 forma A, Zeeb et al., 1996 emend. Gilbert et al., 1997; 358, Taylor & Smol in Taylor, 1997 in Wilkinson et al., 2001; 387, Pla, 2001; 10, Hansen, 2001; 314, Brown & Smol in Brown et al., 1997; 93, Duff & Smol, 1991; 228, Duff & Smol, 1994 emend. Wilkinson & Smol, 1998; 8, Coradeghini & Vigna, 2001; 231, forma A, Zeeb & Smol in Zeeb et al., 1996 emend. Duff & Smol, 1994; 88, Duff & Smol, 1991; 159, forma B, Zeeb & Smol, 1993 emend. Wilkinson & Smol in Wilkinson et al., 2001), Wśród nich, sześć po raz pierwszy, odnotowano z Polski (387, Pla, 2001; 10, Hansen, 2001; 314, Brown & Smol in Brown et al., 1997; 93, Duff & Smol, 1991; 231, forma A, Zeeb & Smol in Zeeb et al., 1996 emend. Duff & Smol, 1994; 88, Duff & Smol, 1991) (Ryciny 1–5, Ryciny 8–10), a dwie stomatocysty okazały się również nowe dla Europy (8, Coradeghini & Vigna, 2001; 228, Duff & Smol, 1994 emend. Wilkinson & Smol, 1998) (Ryciny 6–7).
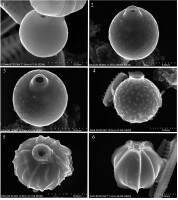
Ryciny 1-6
Stomatocysty. 1 – Stomatocysta 387, Pla (2001); 2–3 – Stomatocysta 10, Hansen (2001); 4 – Stomatocysta 314, Brown & Smol in Brown et al. (1997); 5 – Stomatocysta 93, Duff & Smol (1991); 6 – Stomatocysta 228, Duff & Smol (1994) emend. Wilkinson & Smol (1998).
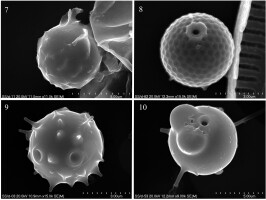
Ryciny 7-10
Stomatocysty. 7 – Stomatocysta 8, Coradeghini & Vigna (2001); 8 – Stomatocysta 231, forma A, Zeeb & Smol in Zeeb et al. (1996) emend. Duff & Smol (1994); 9 – Stomatocysta 88, Duff & Smol (1991); 10 – Stomatocysta 159, forma B, Zeeb & Smol (1993) emend. Wilkinson & Smol in Wilkinson et al. (2001).
Materiał analizowano z czterech różnych mikrosiedlisk w obrębie zagłębienia. W próbach z powierzchni wody nie stwierdzono ani jednego okazu, w toni wodnej tylko jeden okaz, ale nie udało się go zidentyfikować, ponieważ okaz nie miał widocznych wyraźnych cech morfologicznych. W próbach z dna odnotowano 74 okazy, które należały do 25 różnych morfotypów (10 Cabała, 17, 22A, 57, 120, 127, 135, 136A, 152, 171, 183, 189, 196, 211, 260A, 351, 358, 10 Hansen, 314, 93, 228, 8, 231A, 88, 159B). Natomiast w wodzie wyciśniętej z roślin stwierdzono występowanie 17 okazów, które zidentyfikowano jako 7 różnych stomatocyst (120, 171, 196, 351, 387, 93, 159B). Sześć z nich występowało jednocześnie w obu badanych mikrosiedliskach tj. na dnie i w wodzie wyciśniętej z roślin wodnych (120, 171, 196, 351, 93, 159B).
Identyfikacji (JP) dokonano w oparciu o dostępną literaturę fachową (m.in. Duff et al., 1995; Hansen, 2001; Pang & Wang, 2017; Pla, 2001; Wilkinson et al., 2001). Wszystkie zidentyfikowane stomatocysty, wraz z odniesieniem do literatury, rozmieszczeniem w Tatrzańskim Parku Narodowym, rozmieszczeniem w Polsce i na świecie, zestawiono w Tabeli 1. Dodatkowo wszystkie stomatocysty nowe dla Polski i Europy zilustrowano na dwóch tablicach z mikrofotografiami (Ryciny 1–10).
Tabela 1
Stomatocysty stwierdzone w ośmiu próbach z zagłębienia wytopiskowego w Dolinie Suchej Wody.
| Lp. | Stomatocysty | Rycina | Rozmieszczenie w Tatrzańskim Parku Narodowym | Rozmieszczenie w Polsce | Rozmieszczenie na świecie |
|---|---|---|---|---|---|
| 1 | 10, Cabała J. in Wołowski et al. (2004) | - | Nowa dla TPN | Staszów (Wołowski et al., 2004), Wymysłów (Piątek, 2007) | Polska (Piątek, 2007; Wołowski et al., 2004) |
| 2 | 17, Cabała J. in Cabała & Piątek (2004) | - | Staw Toporowy Niżni (Cabała & Piątek, 2004) | - | Polska (Cabała & Piątek, 2004) |
| 3 | 22 forma A, Hansen (2001) | - | Staw Toporowy Wyżni (Cabała, 2005a), Morskie Oko (Cabała, 2005b) | Wymysłów (Piątek, 2007) | Azory (Hansen, 2001) |
| 4 | 57, van de Vijver & Beyens (1997) | - | Staw Toporowy Wyżni (Cabała, 2005a), Czarny Staw Gąsienicowy, Zmarzły Staw Gąsienicowy (Piątek, 2006) | - | Georgia Południowa (van de Vijver & Beyens, 1997), Polska (Cabała, 2005a; Piątek, 2006) |
| 5 | 120, Duff & Smol in Duff et al. (1992) emend. Zeeb & Smol (1993) | - | Staw Toporowy Niżni (Cabała & Piątek, 2004), Staw Toporowy Wyżni (Cabała, 2005a), Zmarzły Staw Gąsienicowy (Piątek, 2006) | Modlniczka (Cabała, 2002), Staszów (Wołowski et al., 2004), rezerwat Owczary (Piątek & Piątek, 2005) | Kanada, U.S.A., Grenlandia (Duff et al., 1995), Europa (Facher & Schmidt, 1996a), Georgia Południowa (van de Vijver & Beyens, 1997, 2000), Pireneje (Pla, 2001), Austria (Kamenik et al., 2001), Argentyna (Coradeghini & Vigna, 2001), Svålbard (Betts-Piper et al., 2004) |
| 6 | 127, Duff & Smol in Duff et al. (1992) | - | Staw Toporowy Wyżni (Cabała, 2005a) | - | Kanada, U.S.A. (Duff et al., 1995), Europa (Facher & Schmidt, 1996a, 1996b), Pireneje (Pla, 2001), Austria (Kamenik et al., 2001), Svålbard (Betts-Piper et al., 2004) |
| 7 | 135, Duff & Smol (1991) in Duff et al. (1992) | - | Staw Toporowy Niżni (Cabała & Piątek, 2004), Staw Toporowy Wyżni (Cabała, 2005a) | Modlniczka (Cabała, 2002) | Kanada, U.S.A., Włochy, Hiszpania, Wyspy Kerguleny, Dania (Duff et al., 1995), Azory (Hansen, 2001), Pireneje (Pla, 2001), Argentyna (Coradeghini & Vigna, 2001) |
| 8 | 136 forma A, Duff & Soml in Duff et al. (1992) emend. Gilbert & Smol in Gilbert et al. (1997) | - | Nowa dla TPN | Rezerwat Góry Wschodnie (Piątek & Piątek, 2008) | Kanada, U.S.A., Hiszpania, Włochy, Południowy Ocean Indyjski (Duff et al., 1995), Pireneje (Pla, 2001), Azory (Hansen, 2001), Austria (Kamenik et al., 2001), Argentyna (Coradeghini & Vigna, 2001) |
| 9 | 152, Zeeb & Smol (1993) | - | Staw Toporowy Wyżni (Cabała, 2005a) | Jezioro Racze, Wyspa Wolin (Rybak, 1987) | Kanada, U.S.A., Polska (Duff et al., 1995), Pireneje (Pla, 2001) |
| 10 | 171, Zeeb & Smol (1993) | - | Nowa dla TPN | Wymysłów (Piątek, 2007) | Kanada, U.S.A., Dania, Polska (Duff et al., 1995), Azory (Hansen, 2001), Pireneje (Pla, 2001) |
| 11 | 183, Brown & Smol in Brown et al. (1994) | - | Staw Toporowy Niżni (Cabała & Piątek, 2004), Staw Toporowy Wyżni (Cabała, 2005a), Zmarzły Staw Gąsienicowy (Piątek, 2006) | Modlniczka (Cabała, 2002) | Grenlandia (Duff et al., 1995) |
| 12 | 189, Zeeb & Smol in Zeeb et al., subm. Duff et al. (1995) | - | Zmarzły Staw Gąsienicowy (Piątek, 2006) | Modlniczka (Cabała, 2002), Staszów (Wołowski et al., 2004), rezerwat Owczary (Piątek & Piątek, 2005) | Kanada, U.S.A., Grenlandia (Duff et al., 1995), Pireneje (Pla, 2001), Svålbard (Betts-Piper et al., 2004) |
| 13 | 196, Duff & Smol (1994) emend. Wilkinson & Smol in Wilkinson et al. (2001) | - | Nowa dla TPN | Staszów (Wołowski et al., 2004), rezerwat Owczary (Piątek & Piątek, 2005) | Dania, U.S.A., Kanada (Wilkinson et al., 2001) |
| 14 | 211, Duff & Smol (1994) | - | Nowa dla TPN | Modlniczka (Cabała, 2003) | Kanada (Duff et al., 1995) |
| 15 | 260 forma A, Zeeb et al. (1996) emend. Gilbert et al. (1997) | - | Nowa dla TPN | rezerwat Góry Wschodnie (Piątek & Piątek, 2008) | U.S.A. (Wilkinson et al., 2001), Azory (jako stomatocysta 281 Gilbert et al., 1997) (Hansen, 2001) |
| 16 | 351, Zeeb & Smol in Szeicz et al. (1998) | - | Staw Toporowy Niżni (Cabała & Piątek, 2004) | Staw Toporowy Niżni (Cabała & Piątek, 2004) | Chile (Wilkinson et al., 2001), Polska (Cabała & Piątek, 2004) |
| 17 | 358, Taylor & Smol in Taylor (1997) (w Wilkinson et al., 2001) | - | Nowa dla TPN | rezerwat Góry Wschodnie (Piątek & Piątek, 2008) | Europa, Georgia Południowa (Wilkinson et al., 2001) |
| 18 | 387, Pla (2001) | Rycina 1 | Nowa dla TPN | Nowa dla Polski | Pireneje (Pla, 2001) |
| 19 | 10, Hansen (2001) | Rycina 2–3 | Nowa dla TPN | Nowa dla Polski | Azory (Hansen, 2001) |
| 20 | 314, Brown & Smol in Brown et al. (1997) | Rycina 4 | Nowa dla TPN | Nowa dla Polski | Kanada (Wilkinson et al., 2001), Svålbard (Betts-Piper et al., 2004) |
| 21 | 93, Duff & Smol (1991) | Rycina 5 | Nowa dla TPN | Nowa dla Polski | U.S.A. (Duff et al., 1995), Europa (Facher & Schmidt, 1996a, 1996b), Svålbard (Betts-Piper et al., 2004) |
| 22 | 228, Duff & Smol (1994) emend. Wilkinson & Smol (1998) | Rycina 6 | Nowa dla TPN | Nowa dla Polski | Nowa dla Europy. Argentyna (Coradeghini & Vigna, 2001) |
| 23 | 8, Coradeghini & Vigna (2001) | Rycina 7 | Nowa dla TPN | Nowa dla Polski | Nowa dla Europy. Argentyna (Coradeghini & Vigna, 2001) |
| 24 | 231, forma A, Zeeb & Smol in Zeeb et al. (1996) emend. Duff & Smol (1994) | Rycina 8 | Nowa dla TPN | Nowa dla Polski | Kanada (Duff et al., 1995; Wilkinson et al., 2001), Pireneje (Pla, 2001), Svålbard (Betts-Piper et al., 2004), Meksyk (Vilaclara et al., 2005) |
| 25 | 88, Duff & Smol (1991) | Rycina 9 | Nowa dla TPN | Nowa dla Polski | Kanada, U.S.A. (Duff et al., 1995), Europa (Facher & Schmidt, 1996a), Pireneje (Pla, 2001) |
| 26 | 159, forma B, Zeeb & Smol (1993) emend. Wilkinson & Smol in Wilkinson et al. (2001) | Rycina 10 | Nowa dla TPN | - | Kanada, Alaska, U.S.A., Polska (Wilkinson et al., 2001), Pireneje (Pla, 2001) |
. Dyskusja
Badania nad stomatocystami złotowiciowców prowadzone były w ramach grantu nr 2 P04G 023 28, na lata 2005–2008 (MNiSW), w różnych miejscach/siedliskach Tatrzańskiego Parku Narodowego, w tym m.in. w dwóch, blisko siebie położonych Stawach Toporowych: Niżnim (STN) (49°17′02″N, 20°01′50″E), Wyżnim (STW) (49°16′48.5″N, 20°01′47″E) oraz nienazwanym zagłębieniu wytopiskowym (ZW) (49°16′ 50″N, 20°01′55″E) w Dolinie Suchej Wody. W STN zidentyfikowano 31 stomatocyst, w STW 36 morfotypów, a w ZW 26 różnych cyst. Tylko trzy stomatocysty: 120, 135 i 183 występowały we wszystkich trzech Stawach Toporowych. Największe podobieństwo w składzie stomatocyst odnotowano między STN i STW, ponieważ “wspólnych” morfotypów było pięć: 9, 73, 86, 204 i 308. Tylko trzy wspólne stomatocysty (57, 127, 152) były obserwowane w STW i ZW, a w STN i ZW dwie wspólne cysty (17, 351). Podobieństwo w składzie taksonomicznym stomatocyst między trzema stanowiskami jest małe. Wynikać to może m.in. z różnic między właściwościami fizyko-chemicznymi wody, głównie pH, temperatury i zawartość tlenu. pH i temperatura wody wynosiły odpowiednio dla STN: pH = 5,0, temp. = 10 °C i STW: pH = 5,5, temp. = 11 °C i ZW: pH = 6,0, temp. = 13 °C (Cabała, 2005a; Cabała & Piątek, 2004). Jak można wnioskować po samym składzie stomatocyst różnice te są istotne, tym bardziej, że temperatura wody i pH to czynniki odgrywające bardzo ważną rolę w inicjacji procesu tworzenia stomatocyst. Dodatkowo temperatura wody ma duży wpływ na rozpuszczalność tlenu w wodzie, dlatego różnice widać również w zawartości tlenu (O2 mg/l): STN 10,0 mg/l, STW 14,9 mg/l i ZW 6,9 mg/l (Cabała, 2005a; Cabała & Piątek, 2004).
Badane obiekty wyraźnie różniły się również pod względem wielkości zagłębień wytopiskowych. STN zajmuje 0,617 ha, ma 5,7 m głębokości, 185,5 m długości i 51,3 m szerokości. Otoczony jest świerkowym lasem, a brzegi jeziora porośnięte są typowymi dla wód gatunkami roślin naczyniowych (Cabała & Piątek, 2004; Łajczak, 1996; Mirek & Piękoś-Mirkowa, 1995). Materiał do badań pobierany był z małego torfowiska, które usytuowane było na północnym brzegu jeziora. STW to torfowisko zajmujące 1,6 ha, porośnięte przez typową dla torfowisk roślinność naczyniową (Cabała, 2005a). Materiał do badań pobierany był z północnej części torfowiska. ZW przez większość 2004 roku było wyschnięte i tylko po deszczach w zagłębieniu obecna była woda, która miała około 1 m głębokości. Należy zatem wnioskować, że różnice w składzie taksonomicznym stomatocyst, a co za tym idzie samych złotowiciowców były wypadkową różnych czynników, zarówno fizyko-chemicznych wody jak i morfometrycznych.
. Podsumowanie
Na podstawie badań nad stomatocystami w Tatrzańskim Parku Narodowym stwierdzono, że w wodach TPN, zwłaszcza na torfowiskach, w jeziorach, stawach i młakach występuje duże ich bogactwo. Do tej pory odnotowano występowanie około 72 stomatocyst, w tym ze Stawu Toporowego Niżnego (Cabała & Piątek, 2004), Stawu Toporowego Wyżniego (Cabała, 2005a), Morskiego i Żabiego Oka (Cabała, 2005b) oraz w mszystym źródlisku pod Małym Kościelcem (Piątek, 2005). Wśród nich 23 morfotypy opisano jako nowe dla nauki (12–30, 33–35 Cabała J. i jedna forma). Można zatem przypuszczać, że dalsze badania przyniosą odkrycia kolejnych morfotypów nowych dla nauki i rzadko podawanych z Europy i świata. Niektóre z nich mogą się okazać endemiczne dla obszaru Tatr.

