Corneal polymegathism and pigmentary retinopathy in MELAS syndrome – a case report
doi: 10.55342/szemhungarica.2022.159.2.69
Case report
Summary
Introduction: MELAS syndrome (mitochondrial encephalopathy, lactic acidosis, and stroke-like episodes) is the most common mitochondrial disease. As it is characteristic of mitochondrial diseases, the symptoms are very heterogeneous and ophthalmic involvement is common.
Case report: In this case report, we present the case of three female patients with MELAS syndrome - one mother and two daughters. Genetic testing confirmed the presence of the disease-specific mtDNA m.3243A>G mutation in all three of them. All patients had symptoms affecting multiple organ systems in addition to ocular manifestation. Mild ptosis, anisocoric and visual field defects could be seen in two patients, one patient had nystagmus. Polymegathism of the cornea endothelium and involvement of the retinal pigment epithelium were observed in all our patients.
Conclusion: The possibility of a mitochondrial disease should be considered in cases of ophthalmic patients with multi-organ complaints. A detailed description of the symptoms as well as a family history may help the diagnosis. Accurate diagnosis can be established by genetic testing. For patients with genetically confirmed MELAS syndrome, a thorough ophthalmic status assessment using specular microscopy and multimodal imaging is strongly recommended due to the anterior and posterior segment involvements.
Összefoglaló
Bevezetés: A MELAS-szindróma (mitokondriális myopathia, encephalopathia, tejsavas acidózis és stroke) a leggyakrabban előforduló mitokondriális betegség. Tünetei a mitokondriális betegségekre jellemzően igen heterogének, és nem ritka a szemészeti érintettség.Esetismertetés: Három MELAS-szindrómás nőbeteg – egy édesanya és két leánya – esetét ismertetjük. Mindhármuknál genetikai vizsgálat bizonyította a betegségre jellemző mtDNS m.3243A>G-mutáció jelenlétét. Mindhárom beteg esetében ismertek voltak több szervrendszert érintő tünetek, amelyek mellett szemészeti érintettség is jelentkezett. Két betegnél találtunk kisfokú ptosist, anisocoriát és látótérdefektust, egy betegnél jelentkezett nystagmus. Mindegyik betegünknél megfigyelhető volt a corneaendothel polymegathismusa és a retinalis pigmentepithelium érintettsége.
Megbeszélés: A szemészeti tünetek mellett változatos, több szervrendszert érintő panaszokkal jelentkező betegek esetén fel kell merülnie mitokondriális betegség lehetőségének, amelyek diagnosztizálásában a tünetek részletes feltérképezése, valamint a családi anamnézis felvétele segíthet. A pontos diagnózis felállítására genetikai vizsgálat segítségével van mód. A genetikailag igazolt MELAS-szindrómás betegeknél feltétlen javasolt az alapos szemészeti státuszfelvétel az elülső és hátsó szegmens érintettség miatt specular mikroszkópia és multimodális képalkotók alkalmazásával.
Keywords
MELAS syndrome, mitochondrial diseases
Kulcsszavak
MELAS-szindróma, mitokondriális betegségek
Bevezetés
A mitokondriális betegségek
A mitokondriumok a szervezet fő energiaszolgáltatói. A sejtek belsejében elhelyezkedő, gömb vagy henger alakú, 0,75-3 µm2 méretű sejtorganellumok (13). Kettős membránrendszerből állnak, amelyek közül a külső membrán feszes, a belső azonban sűrűn redőzött, ezáltal jelentősen növelve a felületét. A különböző típusú sejtekben eltérő számú mitokondrium található, a vörösvértestekben például egyáltalán nincsenek jelen, míg a magasabb energiaigényű szövetekben akár sejtenként 2000 darab is található.
Az energiatermelés mellett számos más funkcióval is bírnak. Szerepet játszanak többek között a sejtek differenciálódásában, a sejtnövekedésben, a sejtciklus szabályozásában valamint az apoptózisban is (9). Legfontosabb feladatuk mégis a sejtek ellátása adenozin-trifoszfát (ATP) molekulákkal. Ez a belső membránban elhelyezkedő, az elektrontranszportláncot alkotó fehérjekomplexek segítségével zajlik, a terminális oxidációnak nevezett folyamat végeredményeképpen.
A belső membránrendszeren belül elhelyezkedő mátrixban található a mitokondriumok saját DNS-genomja. Az emberi mitokondriális DNS (mtDNS) 16 kilobázis nagyságú és cirkuláris szerkezetű, amelyből mitokondriumonként 2-10 kópia van jelen (3). 37 gént kódol, ezek közül 13 expresszál a terminális oxidációban résztvevő fehérjét. Az elektrontranszportlánc felépítésében résztvevő többi fehérjét a sejtmag DNS-e kódolja.
A sejtorganellumok működészavarához külső károsító tényezők is hozzájárulhatnak (pl. UV-sugárzás), gyakoribb azonban, hogy herediter betegség következményeként jelentkeznek. A megtermékenyítés folyamán kizárólag a petesejtből származó mitokondriumok örökítődnek tovább a zigótába, így a mitokondriális betegségek mind anyai öröklődésmenetet mutatnak. Az őssejtben jelen lévő vadtípusú és mutálódott mtDNS-t tartalmazó mitokondriumok a sejtosztódás során különböző arányban jelennek meg a sejtekben, majd minden sejtben a replikáció eredményeképp ez az arány tovább változik. Így minden sejtben egyaránt jelen vannak vadtípusú, valamint mutálódott DNS-sel rendelkező mitokondriumok is, ezt a jelenséget nevezzük heteroplazmiának. Amennyiben a kóros variánsok száma elér egy bizonyos küszöbértéket, a mitokondriális betegség klinikai tünetei manifesztálódnak.
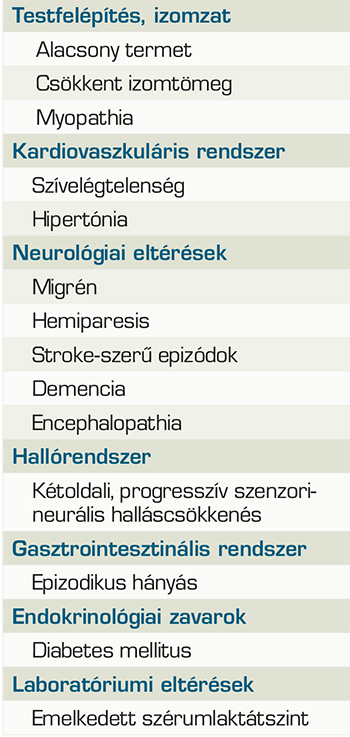
A mitokondriális betegségek klinikai megjelenése igen heterogén. Jellemzően a magas energiaigényű szervek érintettek, tekintettel arra, hogy ezekben a sejtekben jóval nagyobb számú mitokondrium található. Ennek megfelelően leggyakrabban az izmokat, idegrendszert, szívet, májat, emésztőrendszert, hallórendszert és a szemet érintő tünetekkel találkozhatunk. Legfőképp a retinalis pigmenthám, a corneaendothelium és az extraocularis izmok vulnerábilisek. Egyes esetekben a mutációk főként egy szervrendszert érintő betegséget okoznak, mint a Leber-féle herediter opticus neuropathia (LHON) esetében, ahol ritkán fordul elő kardiológiai és neurológiai eltérés is, összességében azonban gyakoribb a több szervet érintő szindrómás formák megjelenése. Mivel a tünetek számos szervrendszerben jelentkezhetnek, valamint a megjelenési forma is igen változatos, a mitokondriális betegségek képesek más megbetegedéseket utánozni, ami meglehetősen nehézzé teszi a diagnózis klinikai tünetek alapján történő felállítását. A Kearns–Sayre-szindróma, a Myoclonus-epilepszia-szindróma (MERRF), valamint a Leigh-szindróma szintén a MELAS-sal átfedő tünetekkel fordulhat elő.
A klinikai vizsgálatok során a több szervet érintő, változatos tünetek esetén fel kell merülnie a mitokondriális betegség lehetőségének. Első lépésként fontos a tünetek részletes feltérképezése, valamint a családi anamnézis felvétele. A pontos diagnózis felállításához genetikai vizsgálatok állnak rendelkezésünkre, a pontmutációkat restrikciós fragmenthossz-analízissel, a teljes mitokondriális genomot Sanger-szekvenálással lehet meghatározni.
A terápia tekintetében jelenleg főként tüneti terápiára van lehetőség valamint vitaminok, piruvát és acetilcisztein adásával van mód a tünetek enyhítésére. A génterápia terén jelenleg is klinikai vizsgálatok vannak folyamatban (11).
MELAS-szindróma
A MELAS-szindróma (mitokondriális myopathia, encephalopathia, tejsavas acidózis és stroke) a leggyakrabban előforduló mitokondriális betegség. Az esetek 80%-ában a mtDNS MTTL1 génjének m.3243A>G szubsztitúciója okozza, maternális öröklődésmenet a jellemző (10). Ritkábban nukleáris elhelyezkedésű, mitokondriális funkcióért felelős gének mutációi okozzák. Az első tünetek megjelenése 10 éves kor körül a leggyakoribb, de akár 2–40 éves kor között is jelentkezhetnek. A leggyakrabban előforduló, nem szemészeti jellegű tüneteket az 1. táblázat foglalja össze. A szemészeti manifesztációk is igen változatos képet mutathatnak, a szem-, illetve függelékeinek különböző struktúráit érintve. Gyakori a ptosis előfordulása, valamint a külső szemizmok érintettsége miatt a szemmozgászavarok jelentkezése. Specular mikroszkópos vizsgálattal korábbi esettanulmányok a cornealis endothelium polymegathismusát mutatták ki. Ugyan a betegek esetében mérhető sejtszám és az átlagos sejtméret is az egészséges populációban mérhető adatokkal megegyező volt, azonban a sejtek mérete jelentős variabilitást mutatott, számos átlagosnál nagyobb sejtet találtak, amelyek mellett jóval kisebb méretűek helyezkedtek el (2). Az elülső szegmentum vizsgálata során foltos íriszatrófiát is megfigyeltek. A lencsehomályok különböző típusait is leírták, maghomály, illetve hátsó subcapsularis homály kialakulásáról is beszámoltak. Szemfenékvizsgálat során opticusatrófiát, makulaérintettséget, koncentrikus perifoveális atrófiát és atípusos retinopathia képét láthatjuk (pigmentary retinopathy). MELAS-ban a stroke-szerű epizódok hozzájárulnak a retrochiasmalis látásvesztéshez, amely hemianopia vagy corticalis látásvesztésként nyilvánulhat meg (8).
A MELAS-szindróma esetén nincs specifikus kezelés, tüneti terápiaként görcsgátló gyógyszereket alkalmaznak a társuló rohamok megelőzésében és ellenőrzésében, valamint koenzim-Q10, riboflavin, antioxidánsok valamint B2- és B3-vitamin szedését javasolják. Metabolikus krízis esetén L-arginin-terápia szükséges infúzió vagy per os adagolás formájában (6, 11). Korábbi esettanulmányok leírták a betegséggel összefüggésben Wernicke–Korsakoff-szindróma, illetve főként negatív tünetekkel járó skizofrénia kialakulását, amelyek terápiájában a cariprazin, valamint a parenterálisan adott tiamin bizonyult hatékonynak (7). A szenzoneurális hallásvesztés kezelésére cochlearis implantátumokat használnak. A mitokondriális betegségek terápiás lehetőségeinek fejlesztését jelenleg is nagy érdeklődés övezi, számos új gyógyszercsoport vizsgálata van folyamatban (12). Ezek közül szemészeti szempontból kiemelt jelentőségű a mitokondriális elektrontranszportlánc működését segítő idebenon, amely az LHON kezelésében mutat biztató eredményeket.
Esetbemutatás
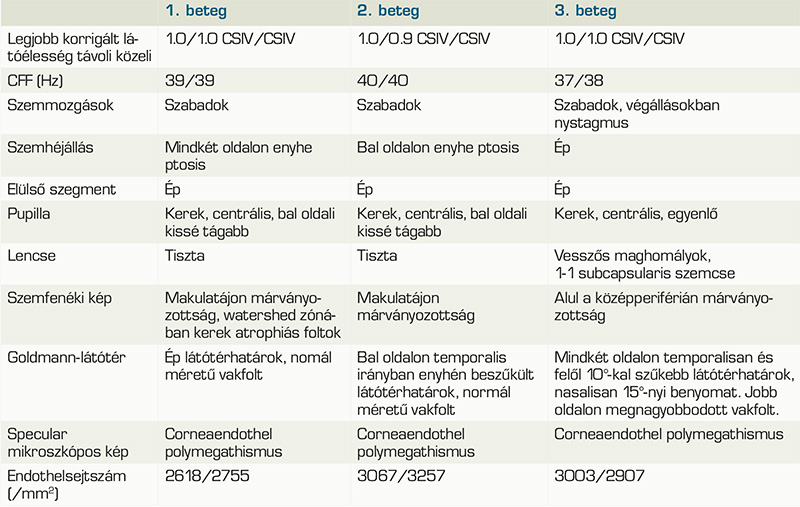
Jelen tanulmányunkban egy édesanya és két leánya esetét ismertetjük. Mindhármuknál genetikai vizsgálattal bizonyították a tipikus mtDNS m.3243A>G-mutáció jelenlétét. A vizsgálatok során talált eltéréseket a 2. táblázat foglalja össze.
1. eset
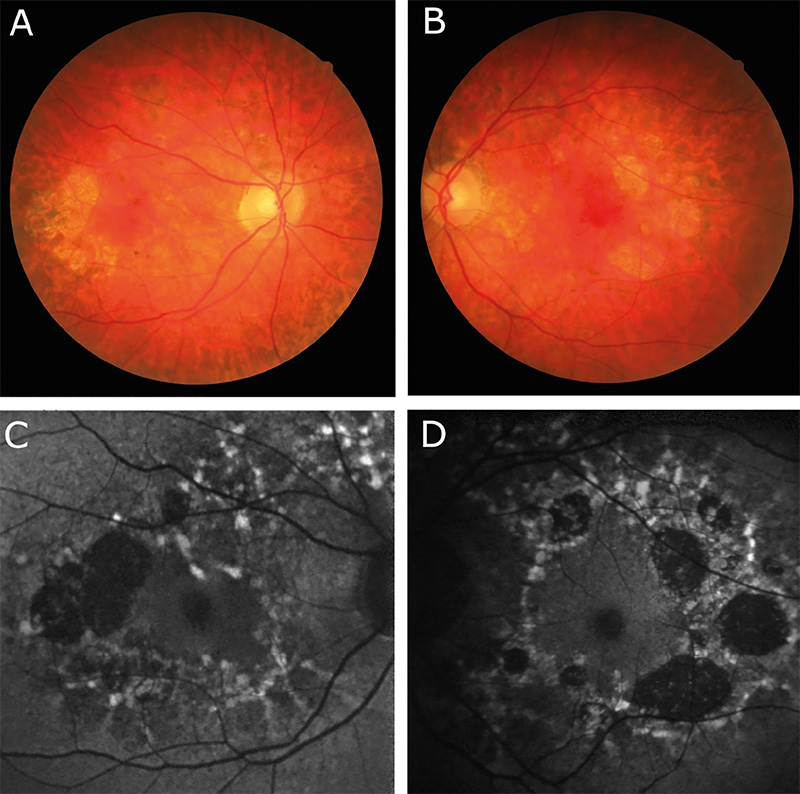
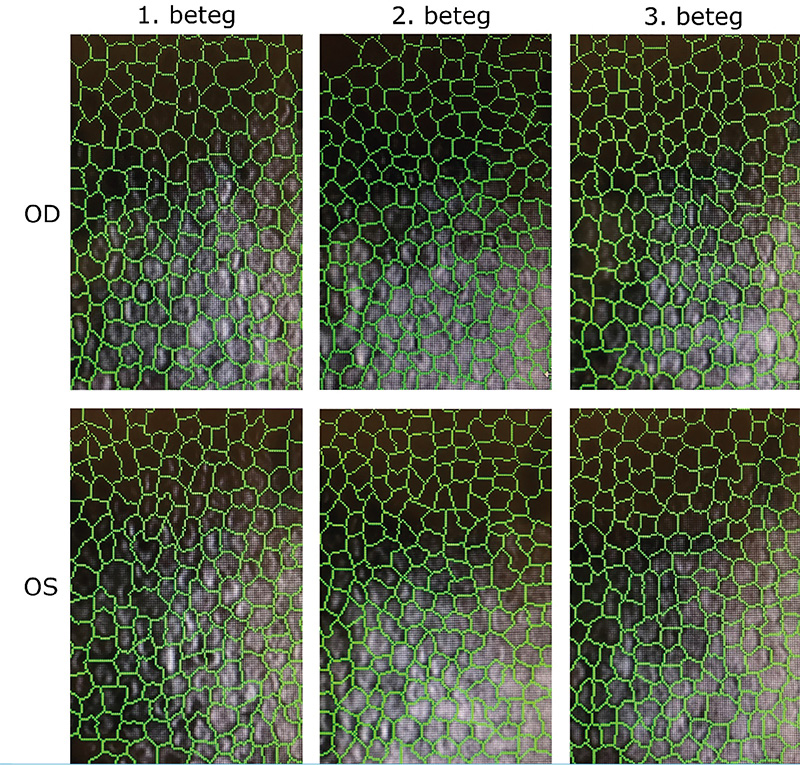
Az 58 éves nőbeteg általános anamnéziséből kiemelendő a tizenöt évvel korábban diagnosztizált 2-es típusú diabetes mellitus. Kisfokú halláscsökkenése 46 éves korában kezdődött, amely azóta fokozatosan progrediált. 55 éves korában jelentkeztek myalgiás panaszai, lábai görcsölnek és fájnak. Vizsgálata során a kezeiben enyhe tremor volt megfigyelhető, amely elmondása szerint gyermekkora óta fennáll. Emésztőrendszeri panaszok közül bizonyos ételek fogyasztásával összefüggő székrekedést, puffadást említ, valamint gyakori hasi diszkomfortról számolt be. Szemészeti panaszként szárazszeműséget, főként reggelente jelentkező égőérzést említett, amelyek enyhítésére időnként műkönnycseppet használ. Szemészeti vizsgálat során mindkét szemen jó távoli és közeli látóélességet találtunk. Szemmozgásai minden tekintési irányba szabadok voltak. Mindkét oldalon kisfokú ptosis volt megfigyelhető, a felső szemhéjszél elérte a pupilla felső szélét. A pupillák kerekek, centrálisak voltak, fényre jól reagáltak, azonban a bal pupilla az ellendoldalinál kissé tágabb volt. A fundus vizsgálata során, makulatájon pigmentepitheliopathiát, valamint a watershed zónában kerek atrófiás foltokat láttunk (1. ábra). Az elvégzett Goldmann-látótér-vizsgálat ép látótérhatárokat mutat, scotoma nem igazolódott. Specular mikroszkópiás vizsgálatot végeztünk, amelyen jól látható volt a corneaendothel polymegathismusa.
2. eset
A 28 éves nőbeteg szemészeti panaszként homályos látásról, szemfájdalomról számolt be. 10 éves kora óta ismert kisfokú myopiája, amelyet kezdetben szemüveggel, majd 15 éves kora óta kontaktlencsével is korrigáltak. MELAS-szindrómára jellemző tünetei 22 éves korában kezdődtek, amelyek közül vezető tünetként depresszió, terhelési intolerancia, fáradékonyság, valamint általános gyengeség emelendő ki. Audiológiai vizsgálat során közepes fokú halláscsökkenést mutattak ki. Hasi MR-vizsgálaton mérsékelt hepatomegáliát, diffúz májlézió jeleit, valamint két körülírt, nem identifikált eltérést írtak le. Szemészeti vizsgálaton jó korrigált távoli látóélességet, valamint korrekció nélkül jó közeli látóélességet találtunk azonban a távoli látóélesség-vizsgálata alatt nehezen kooperált, szédülést panaszolt. Amsler-rácson piros foltokat látott, valamint bal szemmel a vonalakat hullámosnak látta. Szemmozgásai szabadok voltak, kettősképet nem jelzett, vizsgálat közben kifejezetten hunyorgott, többször a szeméhez kapott. Fizikális vizsgálata során egy oldali ptosis volt látható a bal felső szemhéjszél elérte a pupilla felső szélét, a két oldal között 0,5 mm oldalkülönbség volt mérhető. Édesanyjához hasonlóan a bal oldali pupilla kissé tágabb volt. A szemfenéki képen a makulatáj finom pigmentizáltsága látszott. Goldmann-látótér-vizsgálat során, a bal szemen temporális irányban 10 fokkal beszűkült izoptert találtunk, amely hátterében felmerült a vizsgálat alatti kooperációs hiba lehetősége. Specular mikroszkópiás képen szintén corneaendothel-polymegathismus volt megfigyelhető.
3. eset
A 35 éves nőbetegünk általános tünetei kamaszkorában nőgyógyászati és gasztrointesztinális panaszokkal valamint generalizált szorongással kezdődtek. Későbbiekben memóriazavar, krónikus fáradtság és depresszió jelentkezett, majd néhány évvel később skizofrénia diagnózisát állították fel. A klinikai tünetek és az elvégzett koponya képalkotó vizsgálat eredménye alapján Wernicke-encephalopathia került leírásra. 16 éves kora óta hord rövidlátó korrekciót, két éve olvasáshoz is szüksége van szemüvegre. Vizsgálatunk során jó közeli és távoli látóélességet találtunk. Szemmozgásai minden tekintési irányban szabadok voltak, azonban a végállásokban nystagmus jelentkezett. A szemhéjak állása megfelelő volt, ptosis nem volt látható. Réslámpás vizsgálattal a szemlencsékben mindkét oldalon fokozott vesszős magreflexet valamint subcapsularis szemcsézettséget találtunk. A szemfenéki képből a temporálisan fiziológiásnál kissé excaváltabb papillák, valamint a középperiférián látható márványozottság, pigmenthám-érintettség emelendő ki. Az elvégzett Goldmann-látótér-vizsgálaton is eltérések voltak láthatók, jobb oldalon a vakfolt kissé megnagyobbodott, valamint mindkét szemen temporálisan 10 fokkal beszűkült látótérhatárok rajzolódtak ki. Nasalisan mindét szemen 15 foknyi benyomat volt látható, azonban ennek hátterében felmerült külső tényező zavaró hatása (maszkviselés). Specular mikroszkópos vizsgálattal szintén polymegathismus képe volt látható.
Megbeszélés
Mindhárom betegnél változatos, több szervrendszert érintő általános tünetek mellett a MELAS-szindrómára jellemző szemészeti tüneteket is találtunk. Kettőjüknél kisfokú ptosis állt fent, valamint mindhárom betegnél corneaendothel-polymegathismus (2. ábra), és a retinalis pigmentepithelium érintettsége látszott. Chang és munkatársai 1993-ban publikálták postmortem elektronmikroszkópos vizsgálataik eredményeit azonos mtDNS m.3243A>G pontmutáció miatt mitokondriális betegségben szenvedő betegeken, amely szerint számos nagyobb méretű, szabálytalan alakú és szerkezetű mitokondriumot találtak a retina vaszkuláris pericitáiban, a szaruhártya-endotheliumban, a retinalis ganglionsejtekben, a neuroretina külső és belső nukleáris rétegében, és az extraocularis izmokban. A szaruhártya endotheliumában vakuolákat figyeltek meg, amelyben debrist és számos nagy, fibrilláris és granuláris depozitumokat tartalmazó mitokondriumot találtak. Ez a jelenség magyarázatot adhat az endothel polymegathismusára. Emellett nem találtak kóros mitokondriumokat a Müller-sejtekben (4). Az irodalomban ismert MELAS-betegeknél szintén megfigyelték az életkori átlagnak megfelelő endothelsejtszám-denzitást, azonban a kvalitatív analízis minden esetben megnagyobbodott endothelsejtek jelenlétét mutatta ki, főként a cornea perifériáján (2). Ismert, hogy cukorbetegségben fokozott a cornea endothelialis polymegathismusa (1), azonban az általunk vizsgált 3 nőbeteg közül csak az anya volt igazolt cukorbeteg, a cornea endothelsejtjeinek méretbeli heterogenitását azonban mindhármuk esetén megtaláltuk. Mindhármuk esetén további követés szükséges, a leányoknál obszerválni kell a diabétesz esetleges megjelenését.
A különböző mitokondriális szindrómákban előforduló retinalis pigmenthám-elváltozások eltérő mértékűek az m.3243A>G mutációval rendelkező betegek körében. Ezen okuláris manifesztáció összefüggése a szisztémás érintettséggel egyelőre tisztázatlan (10).
A genetikailag igazolt m.3243A>G mutációval élő betegeknél feltétlen javasolt az alapos szemészeti státuszfelvétel az elülső és hátsó szegmens érintettség miatt specular mikroszkópia és multimodális képalkotók alkalmazásával, valamint a követés.
Nyilatkozat
A szerzők kijelentik, hogy az esetismertetés megírásával kapcsolatban nem áll fenn velük szemben pénzügyi vagy egyéb lényeges összeütközés, összeférhetetlenségi ok, amely befolyásolhatja a közleményben bemutatott eredményeket, az abból levont következtetéseket vagy azok értelmezését.
Irodalom
1. Anbar M, Ammar H, Mahmoud RA. Corneal Endothelial Morphology in Children with Type 1 Diabetes. J Diabetes Res 2016; 2016: 7319047. https://doi.org/10.1155/2016/7319047
2. Bakhoum MF, Wu WP, White EC, et al. Mitochondrial A3243G mutation results in corneal endothelial polymegathism. Graefes Arch Clin Exp Ophthalmol Mar 2018; 256(3): 583–588. https://doi.org/10.1007/s00417-018-3914-z
3. Chan DC. Mitochondria: dynamic organelles in disease, aging, and development. Cell Jun 2006; 125(7): 1241–52. https://doi.org/10.1016/j.cell.2006.06.010
4. Chen TC, Cense B, Pierce MC, et al. Spectral domain optical coherence tomography: ultra-high speed, ultra-high resolution ophthalmic imaging. Arch Ophthalmol Dec 2005; 123(12): 1715–20. https://doi.org/10.1001/archopht.123.12.1715
5. Daruich A, Matet A, Borruat FX. Macular dystrophy associated with the mitochondrial DNA A3243G mutation: pericentral pigment deposits or atrophy? Report of two cases and review of the literature. BMC Ophthalmol Jun 2014; 14: 77. https://doi.org/10.1186/1471-2415-14-77
6. El-Hattab, Ayman W et al. MELAS syndrome: Clinical manifestations, pathogenesis, and treatment options. Molecular genetics and metabolism 2015; 116(1–2): 4–12. https://doi.org/10.1016/j.ymgme.2015.06.004
7. Jimoh IJ, Sebe B, Balicza P, et al. Wernicke-Korsakoff syndrome associated with mtDNA disease. Ther Adv Neurol Disord 2020 Jul 30; 13: 1756286420938972. https://doi.org/10.1177/1756286420938972
8. Kisilevsky E, Freund P, Margolin E. Mitochondrial disorders and the eye. Surv Ophthalmol. 2020 May – Jun 2020; 65(3): 294–311. https://doi.org/10.1016/j.survophthal.2019.11.001
9. McBride HM, Neuspiel M, Wasiak S. Mitochondria: more than just a powerhouse. Curr Biol Jul 2006; 16(14): R551–60. https://doi.org/10.1016/j.cub.2006.06.054
10. Mehrazin M, Shanske S, Kaufmann P, et al. Longitudinal changes of mtDNA A3243G mutation load and level of functioning in MELAS. Am J Med Genet A Feb 2009; 149A(4): 584–7. https://doi.org/10.1002/ajmg.a.32703
11. Santa KM. Treatment options for mitochondrial myopathy, encephalopathy, lactic acidosis, and stroke-like episodes (MELAS) syndrome. Pharmacotherapy 2010; 30(11): 1179–1196. https://doi.org/10.1592/phco.30.11.1179
12. Singh A, Faccenda D, Campanella M. Pharmacological advances in mitochondrial therapy. EBioMedicine 2021; 65: 103244. https://doi.org/10.1016/j.ebiom.2021.103244
13. Wiemerslage L, Lee D. Quantification of mitochondrial morphology in neurites of dopaminergic neurons using multiple parameters. J Neurosci Methods Mar 2016; 262: 56–65. https://doi.org/10.1016/j.jneumeth.2016.01.008
