Articles
- Page Path
- HOME > J Powder Mater > Volume 26(6); 2019 > Article
-
ARTICLE
유무기 하이브리드 티타늄 착화합물을 이용한 티타니아의 제조 방법 및 성장 거동에 대한 연구 - 강유빈a, 최진주a, 권남훈b, 김대근a, 이근재b,*
- A Study on the Preparation and Growth Mechanism of Titanium Dioxide using Organic-Inorganic Hybrid Titanium Complex
- Yubin Kanga, Jin-Ju Choia, Nam Hun Kwonb, Dae-Guen Kima, Kun-Jae Leeb,*
-
Journal of Korean Powder Metallurgy Institute 2019;26(6):487-492.
DOI: https://doi.org/10.4150/KPMI.2019.26.6.487
Published online: November 30, 2019
a 고등기술연구원 융합소재연구센터
b 단국대학교 에너지공학과
a Material Science & Chemical Engineering Center, Institute for Advanced Engineering, Yongin 17180, Republic of Korea
b Department of Energy Engineering, Dankook University, Cheonan 31116, Republic of Korea
- *Corresponding Author: Kun-Jae Lee, TEL: +82-41-550-3684, FAX: +82-41-559-7914, E-mail: kjlee@dankook.ac.kr
- - 강유빈·최진주: 연구원, 권남훈: 학생, 김대근: 선임연구원, 이근재: 교수
• Received: November 20, 2019 • Accepted: December 12, 2019
© The Korean Powder Metallurgy Institute. All rights reserved.
- 21 Views
- 0 Download
- 1 Crossref
Abstract
- Titanium dioxide (TiO2) is a typical inorganic material that has an excellent photocatalytic property and a high refractive index. It is used in water/air purifiers, solar cells, white pigments, refractory materials, semiconductors, etc.; its demand is continuously increasing. In this study, anatase and rutile phase titanium dioxide is prepared using hydroxyl and carboxyl; the titanium complex and its mechanism are investigated. As a result of analyzing the phase transition characteristics by a heat treatment temperature using a titanium complex having a hydroxyl group and a carboxyl group, it is confirmed that the material properties were different from each other and that the anatase and rutile phase contents can be controlled. The titanium complexes prepared in this study show different characteristics from the titania-formation temperatures of the known anatase and rutile phases. It is inferred that this is due to the change of electrostatic adsorption behavior due to the complexing function of the oxygen sharing point, which crystals of the TiO6 structure share.
- 티타니아(TiO2)는 대표적인 금속산화물 형태의 무기 화 합물로서, 물리적, 화학적으로 매우 안정하여 단열재의 첨 가제, 염료감응형 태양전지, 화장품, 도료 등 다양한 산업 에 적용되고 있는 기능성 무기소재이다[1-7]. 저차원 기반 의 티타니아를 제조하는 방법은 졸-겔법, 전기분해법, 수 열합성법 등이 대표적으로 알려져 있으며 대부분 반응성 이 높은 TTIP(Titanium tetraisopropoxide) 또는 TiCl4 전구 체를 사용하여 티타니아를 제조한다[8, 9]. 이러한 전구체 를 사용하는 티타니아의 제조 방법들은 오랫동안 많은 연 구가 진행되어 왔으며, 입자사이즈가 균일하고 일정한 결 정상의 고품질 티타니아를 제조할 수 있다는 장점이 있으 나, 전구체로 사용되는 화합물이 공기와 수분에 대한 반응 성이 매우 크고, 유독하며, 가격이 비싸 경제성이 떨어지 는 단점이 존재한다. 이에 따라 최근에는 반응성이 낮고 상대적으로 경제적인 하이드록실기나 카르복실기, 술폰산 기를 가지는 티타늄 착화합물을 이용하여 간단하게 티타 니아를 제조하는 방법이 연구되고 있으나[10, 11], 티타니 아를 타겟팅 하여 제조하는 것이 아닌, 다른 화합물을 제 조하기 위하여 중간물질로 티타니아를 제조하는 연구에 그치고 있다. 이에 관한 대표적인 연구는 M. Kakihana, et al. 이 수산화 티타늄 이온 용액에 다양한 유기산을 첨가 한 후 열처리하여 티타늄 산화물을 제조하는 방법과 티타 늄과 유기산의 착이온 형성 메커니즘에 관한 연구를 진행 한 바 있으며[10], M. Tada et. al 은 시트르산을 이용하여 티타늄을 착이온화 한 후 바륨계 전구체를 첨가하여 BaTiO3 를 제조하는 연구를 수행한 바 있다[11].
- 본 연구에서는 티타늄과 쉽게 반응하는 하이드록실기 외에 추가적으로 카르복실기를 가지는 Complexing agent 를 이용하여 티타늄 착이온 용액과 티타니아를 합성하는 연구를 진행하였다. 제조된 티타니아는 열처리 온도와 작 용기에 따라 다른 상변이 특성을 보임을 확인 할 수 있었 으며, XRD 분석과 FE-SEM 분석을 통하여 각 샘플의 상 변이 특성 및 미세형상의 변화 특성을 확인하였다.
1. 개 요
- Raw material은 TiH2 분말(시그마알드리치, 99%) 0.25 g (5 mmol)를 사용하였으며, Complexing agent로 Hydrogen peroxide(대정화금, 30%) 20 mL를 사용하였다. 용매 pH 조절을 위한 시료는 Ammonia water(대정화금, 35%) 5 mL를 사용하였으며 모든 실험은 25°C의 대기 분위기에 서 실험을 진행하였다. 모든 시료를 혼합한 용액은 비커에 반응 시키며, 용액의 온도가 최대 70°C를 초과하지 않도 록 항온조를 이용하여 냉각시켰다. 혼합 용액을 1시간 동 안 반응시키면 (1) 반응식에 의하여 Yellow-wish 색상을 띄는 PT(Peroxo titante) 용액이 제조된다(pH ≈ 12).
- 제조된 PT 용액을 80°C로 24시간 동안 가열하면 (2) 반 응식에 의하여 겔화 반응이 진행되며, 수산화 티타늄이 제 조된다. 제조된 수산화 티타늄 분말을 대기분위기에서 온 도 조건(200~800°C) 별로 열처리를 진행하면 (3) 반응식 에 의하여 티타니아가 제조된다. PT 용액에 Citric acid(대 정화금 99.9%, Ti : Citric acid mole ratio = 1 : 2)을 Ligand Exchange Agent 로 사용하여 첨가하면, (4) 반응식에 의하 여 Red-orange 색상의 CPT(Citrato peroxo titanate) 용액이 제조된다(pH ≈ 2).
- 제조된 CPT 용액을 위와 동일한 방법으로 80°C에서 24 시간동안 가열하면, (5) 반응식에 의하여 유기산 염이 포 함된 티타늄 염 분말이 제조된다. 제조된 분말은 대기분위 기에서 마찬가지로 온도 조건 (200~800°C) 별로 열처리를 진행하였으며, (6) 반응식에 의하여 티타니아가 제조된다.
- 제조된 샘플의 상변이 특성을 판단하기 위하여 X-ray diffractrometer(XRD, Ultima Ⅳ, Rikaku)를 이용하였으며, Field Emission Scanning Electron Microscope(FE-SEM, Gimini 500, ZEISS)을 이용하여 형상 분석을 실시하였다. 또한, Thermogravimetric and differential thermal analysies (TG/DTA, Thermo plus evo 2, Rigaku)를 이용하여 제조된 샘플의 가열 온도에 따른 열출입과 결정화 온도를 분석하 였다.
2. 실험방법
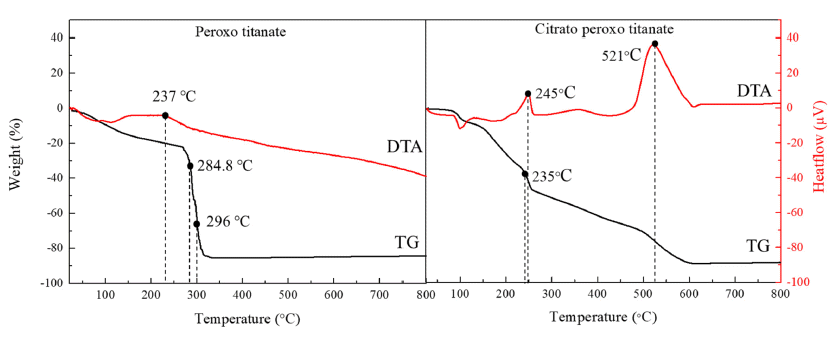
- Fig. 1은 하이드록실기가 포함된 티타늄 착이온 분말 (PT)와 카르복실기가 포함된 티타늄 착이온 분말(CPT)의 TGA 분석 결과 커브이다. PT 분말의 경우, 220~240°C 부 근에서 Broad한 DTA 피크가 존재하는 것을 관찰할 수 있 으며, 이 후 280°C 부근에서 급격한 중량 감소가 일어나 는 모습을 확인할 수 있다. 이는 220~240°C에서 Ti-OH 결 합에서 수소가 산소와 함께 물 형태로 제거되며 Ti-O-Ti 결합의 형태로 변환됨과 동시에 결정화가 일어나는 것으 로 판단된다. CPT의 경우에는 PT와는 달리, 235~250°C 부근에서 1차 열출입이 확인되었고, 500°C에서 600°C에 이르는 온도에서 2차 열출입 피크가 형성되어 있음을 확 인할 수 있다. 1차 열출입 피크 구간에서는 티타늄과 결합 하고 있는 Citrate가 열분해 되는 구간으로 예상되며, 2차 DTA 열출입 피크 구간은 결정화 반응으로 인한 열출입으 로 판단되었다. 따라서 PT와는 달리 CPT의 결정화 온도 가 더 높은 온도에서 이루어지는 것을 확인할 수 있었으 며 대략적인 PT와 CPT의 결정화 온도를 추론할 수 있다. 티타니아의 상 형성은 전구체의 pH, 용액 내 이온의 존재, 작용기, TiO6 Octahedra 단위 결정체의 Oxygen-Sharing Point의 개수 등 다양한 조건에 의하여 결정되는 것으로 알려져 있다[12, 13]. 특히 TiO6 Octahedra의 Oxygen- Sharing Point는 티타니아의 최종 상 결정에 큰 영향을 끼 치며, TiO6 Octahedra 결정체들이 산소 3개와 공유하고 있 다면 Face-Sharing 구조, 2개와 공유하고 있다면 Edge- Sharing 구조를 띄게 된다. Face-Sharing 구조의 경우 종축 성장에 유리하게 작용하여 종축이 긴 형상의 Anatase 형의 티타니아가 결정화되는 반면에, Edge-Sharing 구조의 경우 횡축성장에 유리하게 작용하여 횡축이 긴 형상의 Rutile 형의 티타니아가 결정화되는 주된 원인으로 작용한다.
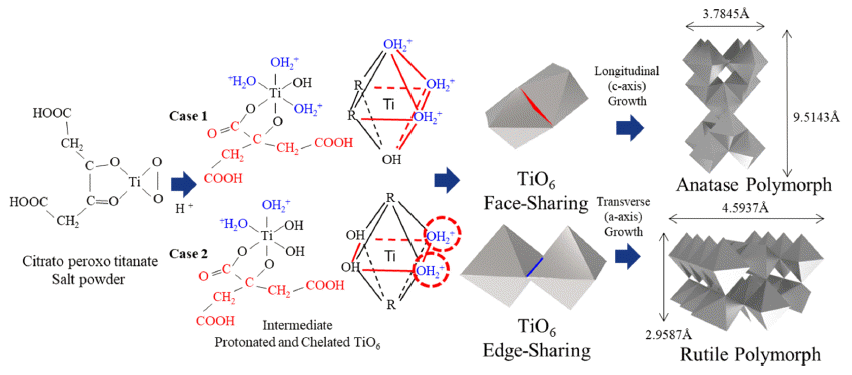
- Fig. 2는 PT의 티타니아 형성 메커니즘을 도식한 그림이 다. PT의 경우 열처리를 진행하면 Anatase 형의 티타니아 가 제조된다. TiO6 Octahedra 결정표면에 수소 이온이 접 촉하여 일시적으로 다른 작용기의 방해 없이 세 꼭지점으 로 양자화 되는 것이 주된 이유로 예상되며, 이로 인하여 표면양자화에 따라 극성을 띄게 된 결정들이 전기적으로 또 다른 결정과 Face-Sharing 형태로 응집하게 된다. Face Sharing 형태로 응집된 TiO6 결정구조체는 결과적으로 종 축 성장에 필요한 응력에 유리하게 작용하여 종축이 긴 형태인 Anatase 형의 티타니아가 성장되는 주된 원인이 된다.
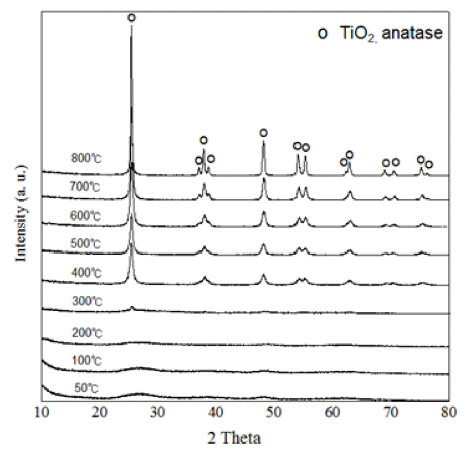
- Fig. 3은 PT의 열처리 온도 별 XRD 커브를 나타낸다. 50~200°C까지의 XRD 패턴은 비정질의 수산화 티타늄으 로 추정되며, 300°C부터 Anatase 상의 티타니아 패턴이 확 인되기 시작하는 모습을 관찰 할 수 있다. 또한 TTIP나 TiCl4같은 기존 전구체를 사용한 티타니아의 경우, 600°C 부근부터 Rutile 상이 성장하며 Anatase와 Rutile 상이 혼 재하는 티타니아가 생성되기 시작하는 것으로 알려져 있 으나[14, 15], 본 연구에서 제조한 PT 분말의 경우에서는 800°C의 열처리 온도에도 Rutile 상의 티타니아의 성장 없 이 순수한 Anatase 상의 티타니아만 관찰되는 것을 확인 할 수 있다. 이는 앞서 설명한 TiO6 단위 결정의 표면 양 자화 현상에 의하여 설명될 수 있다. 기존 전구체의 경우, 상대적으로 친수화도가 낮은 알콕사이드기 또는 클로라이 드기 같은 작용기가 티타늄과 일부 결합한 상태로 존재하 므로 수산화기만 존재하는 구조에 대비하여 수소이온이 상대적으로 흡착되기 어렵게 된다. 이는 TiO6 구조에서 세 꼭지점의 양자화가 아닌, 두 꼭지점의 양자화가 생기는 현 상을 야기한다. 이렇게 야기되는 표면양자화의 감소 현상 은 Face-Sharing이 아닌, Edge-Sharing 형태로 결정체가 응집하게 되어 횡축성장이 진행되도록 하는 원인이 되며, 횡축이 긴 형태인 Rutile 형태로 결정화가 진행되도록 한 다. 하지만, 수산화기 외에 다른 작용기가 존재하지 않는 PT 의 경우, 다른 작용기의 영향 없이 오로지 수산화기의 표면양자화만 원활하게 진행되어 Face-Sharing 형태의 응 집 현상이 고온에서도 유지될 수 있으므로, 600°C 이상의 고온에서도 Anatase 형의 티타니아가 순수하게 존재할 수 있는 것으로 판단된다.
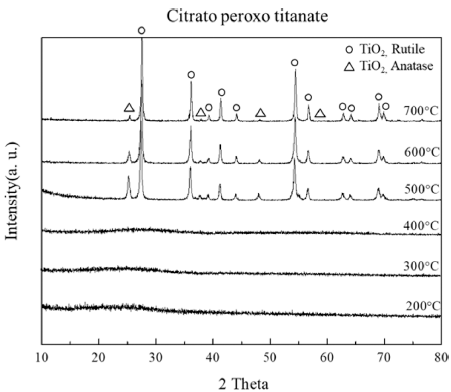
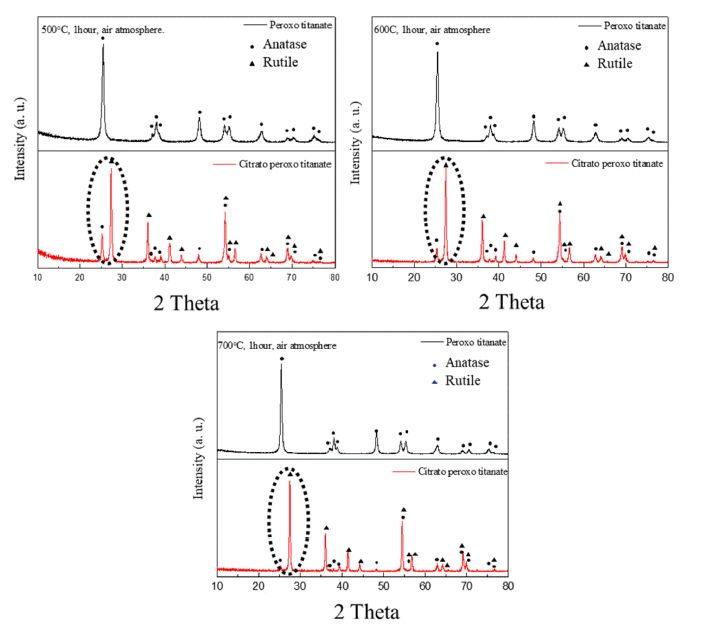
- Fig. 4는 PT 용액을 이용하여 카르복실기가 포함되어 있 는 CPT를 제조한 후 열처리 한 티타니아의 XRD 분석 결 과이다. 200~400°C 열처리 조건에서는 뚜렷한 피크가 존 재하지 않아 비정질 상태로 존재하는 것으로 판단되며, 500°C 이상의 열처리 조건에서 XRD 커브를 분석한 결과 Anatase와 Rutile이 혼재된 티타니아가 제조되었음을 확인 할 수 있었다. 제조된 티타니아는 Anatase와 Rutile의 함량 비가 2:8로, Rutile 상이 대부분을 차지하고 있는 것을 확 인하였으며, 열처리 온도를 증가시킬수록 Rutile의 함량이 증가하는 것을 확인할 수 있었다. Anatase와 Rutile 결정상 의 함량비는 XRD 피크의 인텐시티 값을 이용한 Spurr Myer’s Equation을 통하여 계산되었으며[16], 온도별 Anatase와 Rutile 함량비는 Table 1과 같다.
- Fig. 5는 CPT 분말의 열처리에 따른 Rutile 상형성 메커 니즘을 도식화한 그림이다. CPT의 경우 티타늄이 Citrate 형태의 카르복실기 리간드로 착이온화 되어 있다. CPT는 열처리 시 TiO6 단위결정체가 Citrate complex가 중간에 Bridge 역할을 하면서 Edge Sharing 구조의 결정체를 형성 하게 된다. 이 경우 상대적으로 단위 결정 당 공유하고 있 는 Oxygen-Sharing Piont가 Anatase보다 적고, 횡축 성장 에 유리한 응력을 제공하여 횡축이 긴 형태인 Rutile 형으 로 결정이 성장하게 된다.
- Fig. 6은 동일한 조건으로 열처리를 진행하였을 때 PT 분말과 CPT 분말의 XRD 패턴을 나타낸다. CPT는 PT와 달리 Rutile 상의 피크가 확연하게 관찰되었으며 PT의 경 우 Rutile 상의 피크는 전혀 관찰 할 수 없었다. 이러한 현 상은 위에서 설명했던 바와 같이 티타늄과 결합하고 있는 Citrate기의 Bridging 에 의한 Edge Sharing 구조 때문으로 예상되며 이에 따라 두 조건을 비교하였을 때 확연한 차 이가 있음을 확인할 수 있다.
- Fig. 7은 CPT 분말을 열처리 하였을 때 제조된 티타니 아의 온도에 따른 SEM 사진을 나타낸다. 수 십 나노 입 자들이 수 마이크론 단위로 응집 되어 있는 모습을 확인 할 수 있으며, 입자의 형태는 다형체 형태로 불규칙한 모 습을 띄고 있는 것을 관찰 할 수 있다. 반응 온도가 증가 할수록, 입자의 크기는 다소 증가하는 경향을 확인할 수 있었으나, 미세형상에서 온도에 따른 뚜렷한 차이는 확인 할 수 없었다.
3. 결과 및 토론
- 유무기 하이브리드 티타늄 착이온을 이용하여 티타니아 를 제조하고 결정 생성 메커니즘을 분석하였다. 수산화기 로 결합되어 있는 티타늄 착이온(PT)의 경우 수산화기의 표면 양자화와 그에 따른 응집 현상으로 인하여 쉽게 Anatase 형태의 티타니아로 제조되는 사실을 확인할 수 있 었으며, 600°C 이상의 고온에서도 Rutile 상으로 변하지 않는 결과를 확인하였다. 카르복실기로 결합되어 있는 티 타늄 착이온의 경우 수산화기의 표면 양자화의 감소 효과 로 Face Sharing 형태의 응집과 Edge Sharing 형태의 응집 이 복합적으로 나타나면서 Rutile 형태의 결정상이 저온에 서도 쉽게 결정화 되는 결과를 관찰할 수 있었다. 또한 반 응 온도 제어를 통하여 Anatase와 Rutile 함량비를 제어할 수 있음을 확인할 수 있었으며, 이러한 결과는 티타니아를 적용시킬 수 있는 다양한 분야 연구에 도움이 될 것으로 기대된다.
4. 결 론
-
Acknowledgements
- 본 논문은 산업통상자원부의 재원으로 한국에너지기술 평가원(KETEP)의 지원을 받아 연구되었으며 이에 감사드 립니다(No. 20182020109920).
감사의 글
- 1. R. Asahi, T. Morikawa, T. Ohwaki, K. Aoki and Y. Taga: Science, 293 (2001) 269. ArticlePubMed
- 2. J. Yamamoto, A. Tan, R. Shiratsuchi, S. Hayase, C. R. Chenthamarakshan and K. Rajeshwar: Adv. Mater., 15 (2003) 1823. Article
- 3. R. L. Carlin, S. N. Bhatia and C. J. O'Connor: J. Am. Chem. Soc., 99 (1977) 7728. Article
- 4. M. Radecka and M. Rekas: J. Am. Ceram. Soc., 85 (2002) 346. Article
- 5. K. Nakano, E. Obuchi, S. Takagi, R. Yamamoto, T. Tanizaki, M. Taketomi, M. Eguchi, K. Ichida, M. Suzuki and A. Hashimoto: Sep. Purif. Technol., 34 (2004) 67. Article
- 6. S. U. M. Khan, M. Al-Shahry and W. B. Ingler Jr: Science, 297 (2002) 2243. ArticlePubMed
- 7. P. Manivasakan, V. Rajendran, P. R. Rauta, B. B. Sahu, P. Sahu, B. K. Panda, S. Valiyaveettill and S. Jegadesan: J. Am. Ceram. Soc., 93 (2010) 2236. Article
- 8. M. Gotić, M. Ivanda, A. Sekulić, S. Musić, S. Popović, A. Turković and K. Furić: Mater. Lett., 28 (1996) 225. Article
- 9. M. R. Ayers and A. J. Hunt: Mater. Lett., 34 (1998) 290. Article
- 10. M. Kakihana, M. Kobayashi, K. Tomita and V. Petrykin: Bull. Chem. Soc. Jpn., 83 (2010) 1285. Article
- 11. M. Tada, K. Tomita, V. Petrykin and M. Kakihana: Solid State Ion., 151 (2002) 293. Article
- 12. J. A. Chang, M. Vithal, I. C. Baek and S. I. Seok: J. Solid State Chem., 182 (2009) 749. Article
- 13. K. C. Song and S. E. Pratsinis: J. Colloid Interface Sci., 231 (2000) 289. ArticlePubMed
- 14. P. Paunović, A. Grozdanov, A. Češnovar, P. Makreski, G. Gentile, B. Ranguelov and E. Fidančevska: J. Eng. Mater. Technol., 137 (2015) 021003. Article
- 15. D. A. H. Hanaor and C. C. Sorrell: J. Mater. Sci., 46 (2011) 855. Article
- 16. R. A. Spurr and H. Myers: Anal. Chem., 29 (1957) 760. Article
Figure & Data
References
Citations
Citations to this article as recorded by 

- Thermal Stability and Weight Reduction of Al0.75V2.82CrZr Refractory High Entropy Alloy Prepared Via Mechanical Alloying
Minsu Kim, Hansung Lee, Byungmin Ahn
journal of Korean Powder Metallurgy Institute.2023; 30(6): 478. CrossRef
 kpmi
kpmi









 PubReader
PubReader Cite this Article
Cite this Article