Articles
- Page Path
- HOME > J Powder Mater > Volume 23(3); 2016 > Article
-
ARTICLE
산화물 혼합상이 페라이트계 P/M스테인리스강의 고온산화 및 전기저항 안정성에 미치는 영향 - 박진우a, 고병현a, 정우영a, 박동규c, 안인섭a,b,*
- The Effect of Oxide Compound on Electrical Resistivity and Oxidation Stability in High-temperature for Ferritic P/M Stainless Steel
- Jin-Woo Parka, Byung-Hyun Koa, Woo-young Junga, Dong-Kyu Parkc, In-Shup Ahna,b,*
-
Journal of Korean Powder Metallurgy Institute 2016;23(3):240-246.
DOI: https://doi.org/10.4150/KPMI.2016.23.3.240
Published online: May 31, 2016
a 경상대학교 나노 · 신소재 공학부
b 경상대학교 그린에너지 융합연구소
c 경상대학교 링크 사업단
a School of Nano and Advanced Materials Science & Engineering, Gyeongsang National University, 501, Jinju-daero, Jinju-si, Gyeongsangnam-do 52828, Korea
b RIGET, Gyeongsang National University, 501, Jinju-daero, Jinju-si, Gyeongsangnam-do 52828, Korea
c LINC, Gyeongsang National University, 501, Jinju-daero, Jinju-si, Gyeongsangnam-do 52828, Korea
- *Corresponding Author: In-Shup Ahn, +82-55-772-1662, +82-55-772-1670, ais@gnu.ac.kr
© The Korean Powder Metallurgy Institute. All rights reserved
- 25 Views
- 0 Download
Abstract
- In order to improve the high-temperature oxidation stability, sintered 434L stainless steel is studied, focusing on the effect of the addition of metallic oxides to form stable oxide films on the inner particle surface. The green compacts of Fecralloy powder or amorphous silica are added on STS434L and oxidized at 950°C up to 210 h. The weight change ratio of 434L with amorphous silica is higher than that of 434L mixed with Fecralloy, and the weight increase follows a parabolic law, which implies that the oxide film grows according to oxide diffusion through the densely formed oxide film. In the case of 434L mixed with Fecralloy, the elements in the matrix diffuse through the grain boundaries and form Al2O3 and Fe-Cr oxides. Stable high temperature corrosion resistance and electrical resistivity are obtained for STS434L mixed with Fecralloy.
- 최근 전자기부품의 소형화와 직접화에 대한 요구가 많 아짐에 따라 저항재료의 발열방식도 기존의 간접가열방식 이 아닌 직접가열방식의 필요성이 크게 대두되고 있다. 발 열체의 간접 가열 방식은 복사에 의한 열전달 시 가열시 간이 길고 저온영역에서 효율이 낮을 수 있으며, 높은 전 기저항이 요구되기 때문에 얇거나 가늘고 긴 형태가 요구 가 되지만, 접촉식 직접가열 방식은 높은 전기저항체의 구 성으로 히터의 길이와 폭에 제한을 받지 않아서 전기기기 의 직접화와 일체화 및 공정의 단일화가 가능한 장점을 가지고 있다. 일반적으로 많이 사용되고 있는 고온 발열체 로는 Fecraloy로 기존의 열선에 비해 내산화성과 부식저항 성이 뛰어나서 니크롬선과 함께 전기발열체로 주로 사용 된다. Fecraloy는 최고 사용온도가 1450°C로 매우 높으며, 고 온안정성이 매우 좋다는 장점이 있다. 또한 Fe-Cr-Al 합금 은 Al2O3 피막층을 형성하기 위하여 17% 이상의 높은 Al 함량을 필요로 하는 Fe-Al 계 합금에 비해 5% 정도의 낮 은 Al 함량만으로 보호성 Al2O3 피막층을 형성하는 데, 이 러한 이유는 Cr이 합금 내에서 산소에 대한 제 2 흡수제 의 역할을 하여 내부산화를 효과적으로 억제하고 표면 쪽 으로 확산한 Al이 산소와 반응하여 Al2O3를 형성시키기 때문이다[1]. 이와 같이 금속의 고온 내산화성을 향상 시 키는 방법으로는 Al 이나 Si 등의 금속원소를 합금원소로 첨가하는 방법이 잘 알려져 있다. 이들 첨가원소는 산화 초기에 Al과 Si의 산화물이 형성되어 모재 표면에서 Cr의 핵 생성 site로 작용하면서 Cr 산화물의 성장을 촉진시키 므로 표면 Cr2O3 층 형성에 필요한 Cr 임계농도를 줄이는 역할을 하기 때문이다. 또한 900°C 이상의 고온에서도 Cr2O3 산화층 아래의 계면에 안정한 산화물을 형성하면서 추가적인 내산화성을 제공하기 때문에 Al 이나 Si를 첨가 한 Fe-Cr 합금의 내산화성이 크게 향상되는 것으로 보고 된 바 있다[2]. 하지만 이들 발열체는 주조법으로 제조한 다음 인발 가공하여 사용하게 되는데, 이러한 기존의 주조 방법으로는 발열체의 소형화 및 직접화에 대한 요구를 충 족시킬 수가 없기 때문에 가장 유용한 제조방법으로는 분 말 소재를 이용한 분말야금방법이 제기되고 있다.
- 고온 발열체는 고온내산화성이 우수하여야 하며, 고온 에서 높은 전기저항이 요구되어진다. 또한 고온에서 장시 간 사용하여도 내산화성이나 전기저항이 감소되지 않는 안정성이 유지 되어야한다. 그러나 분말야금제품은 주조 법으로 만들어진 소재보다 많은 기공 구조를 가지며 이러 한 넓은 기공면적이 galvanic couple을 형성하여 부식을 촉진시키는 원인이 된다[3, 4]. 또한 고온에서 기공의 형상 변화에 의해 산화저항 및 전기저항의 변화가 발생하며, 다 양한 산화물상이 생성될 뿐만 아니라 소재표면과 개기공 표면에 생성되는 산화피막의 종류와 분포형태 등에 따라 서 산화안정성 및 전기저항특성의 안정성이 크게 달라진 다. 따라서 분말야금법을 고온발열체 제조에 응용할 경우 고려되어야 할 많은 문제점들을 가지고 있으나 아직까지 이에 대한 연구는 거의 수행된 바가 없는 실정이다. 특히 Fecraloy는 표면에 형성된 산화피막으로 인해 고온에서 내 산화성은 크게 증가할 것으로 기대되지만 분말성형 및 소 결성이 나쁘고 높은 전기저항 때문에 고온발열체로 사용 이 어려울 것으로 사료된다. 따라서 고온에서 내산화성을 유지하면서 분말 성형성을 증가시키고 안정화된 고온 전 기저항특성을 얻기 위해서는 고온내식성이 양호한 금속분 말과 혼합된 Fecraloy를 사용할 필요가 있다.
- 고온에서 내식성이 양호한 금속분말은 표면에 보호성 산화막이 잘 형성되어 고온 분위기에서 사용될 때 표면을 보호할 수 있어야 하며, 산화피막이 안정하여 잘 깨지지 않으며 Fecraloy분말과도 결합특성이 좋아야한다. 일반적 으로 오스테나이트 계 스테인리스강은 상온 및 고온에서 내식성 및 내열성이 탁월하여 고온재료로 많이 사용되고 있다. 대표적인 강으로 알려진 STS316L, STS304L은 고온 에서 작동하는 자동차 배기 계의 전단에 위치한 exhaust manifold와 turbocharger 부품 등에 널리 쓰인다[5-7]. 또한 발전 플랜트 산업 분야에서도 고온 강도가 높은 오스테나 이트계 강이 주목을 받아 왔으나, 고온에서 장시간 사용 시 열 피로 파괴 및 스웰링 등과 같은 문제가 발생됨으로 인해 최근에는 페라이트계 스테인리스강에 대한 관심이 점차 높아지고 있다[8, 9]. 페라이트계 스테인리스강은 염 소에 의한 응력부식균열(Stress Corrosion Cracking, SCC) 분위기에 뛰어난 내식성을 보이며, Ni을 함유 하지 않아 오스테나이트계 스테인리스강보다 저렴한 장점이 있다. 또한 고온의 대기 중에서 산소와 반응을 하여 형성된 스 케일은 열팽창계수가 낮기 때문에 냉각 시 오스테나이트 계 스테인리스강 보다 고온 산화스케일에 덜 민감하다 [10-14]. 대표적 강종은 STS430에 Mo을 첨가하여 내식성 을 향상시키고 C 함량을 낮추어 가공성 및 용접성을 개량 시킨 STS434L이 있다.
- 따라서 본 연구에서는 페라이트계 STS434L 분말과 Fecraloy 분말을 혼합하여 성형한 후 950°C의 대기 중에서 성형체의 고온 내산화성과 전기저항 특성을 조사하였다. 또한 SiO2의 영향을 비교 조사하기 위하여 STS434L 분말 과 비정질 실리카를 혼합하여 고온 내산화성과 전기저항 특성에 미치는 영향을 조사하였다.
서 론
- 그림 1과 같이 본 연구에 사용된 평균입도가 40 μm 불 규칙형상의 STS; stainless steel (Korea Standard) 434L 분 말은 Daido 사(일본)의 제품이며, 평균입도가 30 μm 인 구형의 Fecraloy 분말은 Sandvik Osprey Ltd 사(영국)의 제품이다.
- 규산나트륨(Sodium silicate)은 수용성 규산염으로 1018°C 에서 녹기 시작하여 1300°C 이상 되면 완전히 융해된다. 비정질 실리카를 얻기 위하여 규산나트륨을 사용하였으며 curing 이후 평균입도가 30 μm 판상의 규산나트륨을 그림 1 에 나타내었고, 950°C의 시험온도에서 고상의 비정질 SiO2 형태로 되었다.
- Fecraloy분말은 구형의 형상으로 성형성이 떨어져 표 1 과 같은 조성을 가지는 STS434L 분말과 Fecraloy 분말을 1:1 비율로 SPEX Mill을 이용하여 30분 동안 혼합하여 사 용하였다. 또한 비교시편으로 434L에 규산나트륨으로 부 터 석출된 1 wt.% 비정질 SiO2(A-SiO2)를 혼합한 분말을 사용하였다. 그림 2는 규산나트륨을 TGA로 온도에 따른 질량변화를 분석한 그래프로 그림에서 보여주는 바와 같 이 수분의 증발에 의해 300°C까지 질량이 크게 감소하였 으므로 수분을 완전히 제거하기 위해 350°C에서 3시간 동 안 curing 해 주었다.
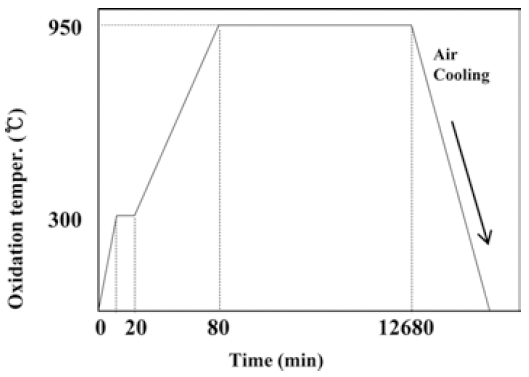
- 혼합한 분말은 유압식 성형프레스를 이용하여 성형하였 으며 성형체는 50 × 4 × 4 mm의 크기를 가지는 bar 형태 로 제조하였다. 성형한 시편의 산화 시간에 따른 고온 산 화 거동 및 전기적 특성을 알아보기 위해서 대기상태의 950°C에서 210시간 동안 산화시켜 산화시간에 따른 산화 거동을 조사하였다. 시간에 따른 산화실험공정을 그림 3 에 나타내었고 승온시간 30°C/min 으로 300°C까지 가열하 여 10분 예열을 한 다음, 승온시간 15°C/min으로 목표 온 도까지 가열해 주었다. 시편은 각 시간대별로 로에서 꺼내 어 공냉을 실시하였으며, 시편의 무게변화율을 측정하였 다. 또한 고온 산화 시험 후 생성된 산화물들의 상변화를 X-선 회절기(X-ray diffraction meter)를 이용하여 조사하였 고 성분분석을 위해 EDS(Energy Dispersive Spectroscopy) 측정하였다. 또한 고온에서의 산화시간에 따른 전기저항 을 측정하였다. 전기저항은 Hioki 3540 모델의 전기저항 측정장치를 이용하여 측정하였으며 표면 접촉저항을 최소 화하기 위하여 표면 연삭 후 silver paste을 시편에 바르고 측정하였다.
실험방법
Composition of the used powder (wt.%)
| C | Cr | Al | Mo | Si | Mn | Y | Fe | |
|---|---|---|---|---|---|---|---|---|
|
|
||||||||
| 434L | 0.01 | 16.73 | - | 1.09 | 0.8 | 0.17 | - | Bal |
| Fecraloy | 0.1 | 22.3 | 6.6 | - | - | 1 | 0.2 | Bal |
- 그림 4는 STS434L 성형체와 STS434L에 Fecraloy 및 A-SiO2(비정질 실리카)를 혼합하여 제조된 성형체를 950°C에서 210시간까지 산화시킨 시간에 따른 산화물 증 가량을 보여주는 그래프로 세 가지 시편의 경우 모두 무 게변화율이 10시간까지는 크게 증가하였으나 10시간 이후 부터는 완만하게 증가하였다. 10시간 까지 무게증가율은 STS434L과 A-SiO2 혼합성형체가 가장 크게 증가하였으며 STS434L과 Fecraloy 혼합 성형체가 가장 낮은 증가율을 보였다. 10시간 이후 210시간까지 산화시험의 경우도 STS434L에 Fecraloy를 혼합하였을 때가 가장 무게변화율 의 기울기가 낮았고 A-SiO2를 혼합한 경우가 무게변화율 이 가장 높았으며, 10시간 이후 210시간까지 무게 변화율 의 기울기는 STS434L 성형체와 STS434L과 A-SiO2 혼합 성형체가 비슷하였다. 선행연구에서 금속산화물 첨가 시 산화물이 금속입자 표면에 산화층을 형성하여 산화를 지 연시키는 역할과 Cr산화층을 보호하는 역할을 하여 고온 내산화성에 좋은 영향을 미치는 것으로 보고된 것과는 달 리[15]. 본 실험에서는 A-SiO2를 첨가함으로서 고온 내산 화성이 크게 향상되지 않았다.
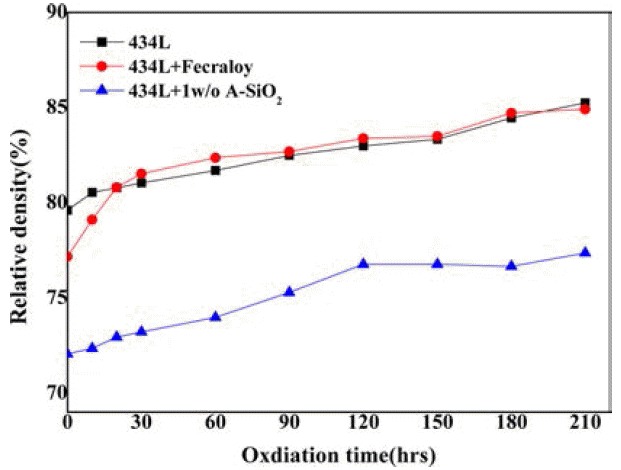
- 산화에 의한 무게증가율은 성형체의 밀도에 의해서도 크게 좌우되는데 그림 5는 산화시간에 따른 밀도변화를 보여주는 그래프로 STS434L과 A-SiO2를 혼합한 성형체 의 경우는 434L 보다도 다소 높은 무게변화율을 관찰할 수 있었는데, 그 원인은 성형성이 나빠서 성형밀도가 너무 낮은데 그 원인이 있는 것으로 판단된다.
- 그림 5에서 보여주듯이 434L과 Fecraloy를 혼합한 시편 의 경우 초기 상대밀도는 기존 434L 보다 낮았지만, 산화 시험시간이 20시간이 지나면서 434L과 비슷한 상대밀도 까지 빠르게 증가하였으나, 상대밀도가 비슷하더라도 그림 4에서 보여주듯이 훨씬 낮은 무게증가율을 나타낸 것으로 보아서 20시간 이후에 Fecraloy표면에 안정한 산 화보호피막이 형성되었음을 짐작할 수 있다. 반면에, ASiO2 혼합 성형체의 경우는 초기밀도는 물론 산화시간이 길어져도 낮은 상대밀도를 보여주었는데 이것은 A-SiO2가 금속입자 표면에 분포하여 434L의 조밀화를 방해하는 역 할을 하면서 성형 시 형성된 많은 기공 채널로 산소가 유 입이 되어 내산화성을 크게 감소시킨 것으로 생각된다.
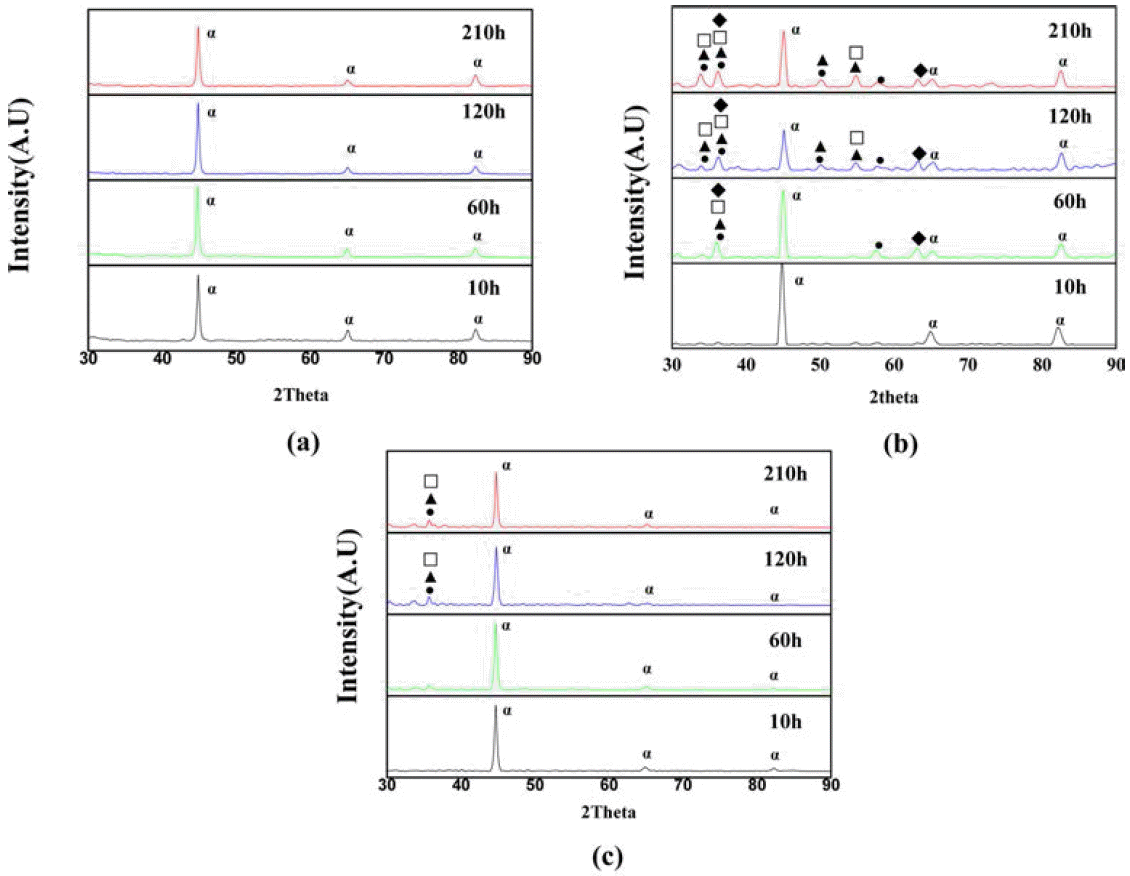
- 그림 6은 대기 중의 950°C에서 210시간까지 산화시험을 진행한 후 각 성형체의 산화시간에 따른 X선 회절 패턴을 보여주는 그림이다. 그림 6(a)에서 보면 434L을 210시간 동안 산화시킨 후에도 α피크 이외에는 다른 산화물상이 나타나지 않았다. 그러나 Fecraloy를 혼합한 경우는 30시 간 산화시험 이후부터는 Fe2O3, Fe-Cr 복합 산화물, Cr2O3 및 Al2O3 등 다양한 산화물들이 생성되었음을 알 수 있다. 이때부터 생성된 산화물은 산화시험이 길어짐에 따라 다 소 강도가 증가하였으며 다른 상은 새로 출현하지 않았다. Al2O3는 고온에서의 안정성이 뛰어난 보호피막을 형성하 지만 산화피막 내부에서 새로운 Al2O3의 생성으로 인해 산화 피막형상이 소용돌이(convolution)[16] 모양을 나타 내기 때문에 모재와의 접착력이 약하다는 단점이 있지만 Al 이온이 입계로 확산되어 Al2O3를 형성함으로써 Cr 산 화층을 형성하는 Cr 임계농도를 줄여 Cr의 결핍을 줄이고 산소유입을 막아 고온 내산화저항성이 향상된 것으로 판 단된다. 따라서 20시간 이후 출현한 Al2O3 및 Cr2O3 상이 고온에서의 내산화성과 안정화를 유지시킨 것으로 생각된 다. 434L에 A-SiO2를 혼합한 경우도 약간의 산화물 피크 가 관찰되었으나, SiO2는 비정질상으로 존재하기 때문에 피크가 관찰되지 않은 것으로 생각된다.
- 그림 7은 210시간 산화시험 후 STS434L과 Fecraloy 혼 합성형체와 STS434L의 EDS 분석결과이다. Fecraloy와 혼 합 성형체에서는 Fecraloy입자표면에 알루미늄 산화피막 이 균일하게 형성되었음을 확인할 수 있었으며, 그 입자들 사이에 434L 입자들이 necking 되어 성장하였음을 볼 수 있다. 434L과 Fecraloy 혼합 성형체의 고온 내산화성을 향 상시킨 요인이 Fecraloy의 Al 이온이 입계로 확산되어 Cr 산화층을 형성하는 Cr의 임계농도를 줄여 Cr이온의 결핍 을 줄이고 선택적으로 Cr 또는 Al 산화물을 형성하여 보 호피막역할을 하게 된 것으로 판단된다. 그러나 A-SiO2를 첨가한 (c)의 경우도 입계에 Si 함량이 많이 분포 하고는 있으나 산화피막을 제대로 형성하지 못해서 보호역할을 하지 못한 것으로 생각된다.
- 그림 8은 위의 시편을 각각의 산화시간별로 전기비저항 을 측정한 그래프이다. 소결이 진행되면 전기저항의 감소 가 일어나므로 전기저항을 측정하여 고온 안정성에 대한 검토를 하였다. Fecraloy 및 A-SiO2가 혼합될 경우 산화시 험 초기에는 높은 비저항 값이 나타났으며, 산화시험이 진 행됨에 따라 비저항 값이 감소되는 것을 관찰할 수 있었 다. 434L보다는 434L과 Fecraloy를 혼합한 경우가 더 높 은 전기저항값을 보여주었고, 434L에 A-SiO2를 혼합한 경 우는 낮은 성형밀도 때문에 높은 비저항값을 보였다. ASiO2 를 혼합한 시편의 경우 60시간 이후에는 전기비저항 이 급격히 감소하였다. 소결이 진행되면 입자간의 neck성 장이 일어나면서 전기가 흐를 수 있는 통로가 확보되고 절연의 효과를 가지는 기공이나 산화물의 영역이 좁아지 면서 산화 시간이 경과함에 따라 전기저항이 감소하는 소 결초기단계인 것으로 생각된다. 90시간 이후에도 지속적 인 전기저항의 감소가 일어나고 있으며 산화에 의한 무게 증가도 지속적으로 증가하는 양상이 아직 소결이 진행되 면서 내산화성과 전기비저항 및 밀도 등이 변하는 즉, 안 정화단계에 이르지 않았음을 보여주고 있다. 따라서 혼합 된 A-SiO2가 치밀화는 억제할 수 있었으나 입자성장을 억 제에는 크게 기여하지 못한 것으로 생각된다. 434L의 경 우도 90시간 이후에는 전기비저항 값은 안정화단계에 이 르렀지만 산화에 의한 무게증가와 산화시간에 따른 밀도 증가는 지속적으로 나타났으므로 안정화단계에 이르렀다고 판단하기는 어렵고 이는 소결중기단계에서의 입자성장과 치밀화가 지속적으로 진행은 되었으나 입자표면에 치밀한 보호피막이 형성되지 못했기 때문인 것으로 생각된다.
- 434L과 Fecraloy혼합의 경우는 초기에 상대밀도가 증가 함에 따라 소결 역시 전기저항의 감소가 빠르게 진행되어 30시간 까지 비저항의 값이 급격히 감소하지만 120시간 이후에는 일정한 값이 유지되었고, 산화시간이 증가함에 따라 치밀화는 진행되고 있으나, 산화에 의한 무게증가율 이 거의 완만하게 진행되는 것으로 보아서 434L 입자에 의한 성장과 조밀화는 진행되더라도 입자 표면에 Cr2O3, Al2O3 같은 산화 피막이 형성되면서 Fecraloy 입자는 크게 성장하지 않는 안정화단계에 도달한 것으로 생각된다.
- 추후 Fecraloy와 434L 분말의 혼합비를 변화시키면서 전기비저항값의 변화와 조직안정성과의 관계와 Fecraloy 입자표면에 형성되는 산화피막의 생성속도를 제어하는 연 구를 수행할 필요가 있다.
실험결과 및 고찰
Weight change ratio of Fecraloy or A-SiO2 added specimens after oxidation tests at 950°C for 210 hrs in air.

X-ray diffractograms corresponding to respective specimens after different periods of exposure at 950°C in air: (a) STS 434L, (b) STS434L+Fecraloy, (c) STS434L+1w/o A-SiO2.

EDS mapping results of specimens after 210hr exposure at 950°C in air: (a) STS434L, (b) STS434L+ Fecraloy and (c) STS434L+1w/o A-SiO2.

Electrical Resistivity of Fecraloy and A-SiO2 added specimens after oxidation tests at 950°C for 210 hrs in air.

- STS434L에 Fecraloy 및 A-SiO2를 첨가하여 950°C에서 210시간까지 산화시험 결과 다음과 같은 결론을 얻을 수 있었다.
- A-SiO2 첨가 시 낮은 성형밀도와 입자 표면에 보호피막 산화층이 형성되지 않아 고온 내산화성이 매우 저조하였 다. Fecraloy 첨가 시 산화시간에 따라 434L과 비슷한 상 대밀도 거동을 보였으며 Cr과 Al의 선택적 산화에 의한 연속적인 보호성 산화피막을 발달시켜 고온 내산화성은 434L보다 양호하였다.
- STS434L에 Fecraloy를 첨가하였을 경우 고온 산화안정 성과 전기저항의 안정성을 꾀할 수 있었다.
결 론
-
Acknowledgements
- 본 논문은 한국연구재단(NO. NRF-2013R1A1A2063036) 의 지원으로 수행되었으며 이에 감사드립니다.
감사의 글
- 1. W Howard and J Pickering: J. Electrochem. Soc., (1972) 119 641.
- 2. F H Stott and F I Wei: Oxid. Met., (1989) 31 369.
- 3. A V C Sobral, M P Hierro, F J Prez, Jr W Ristow, and C V Franco: Mater. Corros., (2000) 51 791.
- 4. I S Lee: J. Korean Inst. Met. Mater., (2009) 47 716(Korean)
- 5. R K Wild: Corros. Sci., (1977) 17 87.
- 6. J T Bittel, L H Sjodahl, and J F White: Corros. Sci., (1969) 25 7.
- 7. S C Kuiry, S Seal, S K Bose, and S K Roy: ISIJ Int., (1994) 34 599.
- 8. R L Klueh, P J Maziasz, I S Kim, L Heatherly, D T Hoelzr, N Hashimoto, E A Kenik, and K Miyahara: J. Nucl. Mater., (2002) 773 307.
- 9. I-S Kim, C-Y Kang, C-H Sung, T Okuda, K Miyahara, P J Maziasz, and R L Kluech: Met. Mater. Int., (2000) 6 513.
- 10. J H Ryu and K S Lee: J. Corros. Sci. Soc. of Kor., (1992) 21 69(Korean)
- 11. H-S Kim: J. Korean Powder Metall. Inst., (2013) 20 432(Korean)
- 12. A Tiziani, A Molinari, L Fedrizzi, A Tomasi, and P L Bronora: Corros. Sci., (1990) 45 672.
- 13. A Sharon and D Itzhak: Mater. Sci. Eng. A., (1997) 224 177.
- 14. S Y Chen and Tsai W T Kuan S. L.: Corros. Sci., (2006) 48 634.
- 15. A Bautista, F Velasco, and J Abenojar: Corros. Sci., (2002) 45 1343.
- 16. F A Golightly, F H Stott, and G C Wood: Oxid. Met., (1976) 10 163.
References
Figure & Data
References
Citations

 kpmi
kpmi





 PubReader
PubReader Cite this Article
Cite this Article