BENTHIC FAUNA OF THE SOUTH-WESTERN PART OF THE SEA OF AZOV: TRANSFORMATION OF MACROZOOBENTHOS BIOCOENOSIS AT THE BEGINNING OF THE XXI CENTURY
JOURNAL: «EKOSISTEMY», Issue 26, 2021
Publication text (PDF):Download
UDK: 594.151:574.587(26.03)(262.54)
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Revkov N. K., Boltachova N. A.
- O. Kovalevsky Institute of Biology of Southern Seas, Russian Academy of Sciences, Sevastopol, Russia
TYPE: Article
DOI: https://doi.org/10.37279/2414-4738-2021-26-51-66
PAGES: from 51 to 66
STATUS: Published
LANGUAGE: Russian
KEYWORDS: macrozoobenthos, invasive species, long-term changes, biocoenosis, Cerastoderma glaucum, Anadara kagoshimensis, Sea of Azov.
ABSTRACT (ENGLISH):
Cerastoderma biocoenosis has been one of the main biocoenoses that occupied the most extensive areas and prevailed in quantitative development in the benthos of the Sea of Azov for more than 80 years, since the first quantitative description were made there in 1930s. However, the penetration of the bivalve Anadara kagoshimensis (a recent invader to the Black Sea basin) to the Sea of Azov in 1989 determined the beginning of subsequent biocoenotic changes. Systematic benthic surveys were conducted in 2016–2017 during cruises #84, #86, #90, #96, #100 aboard R/V “Professor Vodyanitsky” on the extensive south-western section of the Sea of Azov. The results of the surveys revealed the formation of a single Anadara biocoenosis, in which the previously dominant native species Cerastoderma glaucum and Abra segmentum became subdominants. The present research continues the analysis of these data. Its purpose is to assess the features of transformation the Cerastoderma biocoenosis, which was the main native biocoenosis in the Azov Sea – to the biocoenosis of alien species Anadara kagoshimensis. The paper uses materials of three time-periods corresponding to different levels of salinity of the Sea of Azov: 1930s (9.3–11.1 %), the 1950s (11.6–12.1 %) and 2016–2017 (13.5–14.0 %). The results of the analysis showed a high level of similarity (60 %) in the composition of the cores of two native biocoenoses of Abra and Cerastoderma and the new Anadara biocoenosis. The transformation of the native biocoenoses on the southwestern section of the basin into the Anadara biocoenosis resulted both from the successful expansion of A. kagoshimensis and a decrease in the quantitative development of the aboriginal species complex under the conditions of increasing salinity of the basin. A compensatory increase in the quantitative development of zoobenthos was observed in 2016–2017 exceeding that of the 1930s due to A. kagoshimensis. From 1930s to 1950s the number of species in the Cerastoderma biocoenosis in the groups of Mollusca, Polychaeta and “Other species” did not change significantly, but in Crustacea group it decreased by more than 2 times. From 1950s (Cerastoderma biocoenosis) to 2016-2017s (Anadara biocoenosis) there was a nearly two-fold increase in the number of species in the groups of Mollusca, Polychaeta and “Other species” while the number of Crustacea species increased slightly.
ВВЕДЕНИЕ
Изучение структурной организации (биоценозов) донной фауны Азовского моря берёт начало со ставшей уже классической работы В. П. Воробьева (1949) «Бентос Азовского моря». На основе материала, собранного в период с 1933 по 1939 год на 1,5 тыс. станциях, автор провёл детальный анализ состава и биоценотической организации зообентоса Азовского моря. В выделенных им пяти фаунистических районах бассейна (восточная часть Таганрогского залива, западная часть Таганрогского залива, собственно Азовское море, Утлюкский лиман, Сиваш и солёные кубанские лиманы) было зарегистрировано 136 видов макрозообентоса, входящих в состав 15 олигомикстных (сформированы небольшим числом видов) биоценозов (Воробьев, 1949). Донная фауна собственно Азовского моря была представлена семью основными биоценозами – Hydrobia, Abra (Syndesmia), Cerastoderma (Cardium), Mytilaster, Amphibalanus, Alitta (Nereis), Lentidium (Corbulomia) – из которых только два (Cerastoderma и Abra) являлись наиболее распространенными и занимали соответственно 32 и 32 % (весной) и 38 и 28 % (осенью) площади всех биоценозов. Коэффициент общности видов в них был одним из самых высоких среди всех биоценозов собственно Азовского моря (61), уступая только аналогичному коэффициенту биоценозов Nephtys и Amphibalanus (73). В биоценозах Abra и Cerastoderma 1930-х годов было зарегистрировано 44 вида – 32 % от их общего количества в бентосе Азовского моря.
Последующие исследования в 1950–1957 годы показали наличие в бентосе Азовского моря 20 биоценозов, из которых 14 были отмечены в собственно Азовском море (Старк, 1960). Они имели динамические границы и различались степенью своего развития (вплоть до отсутствия в бентосе региона) в различные сезоны и годы. Постоянно регистрируемыми в различные сезоны 1950-х годов были только 10 биоценозов – двустворчатых моллюсков Cerastoderma, Abra, Lentidium, Mytilaster, гастроподы Hydrobia, усоногого рака Amphibalanus, полихет Nephtys, Alitta (Nereis) и не идентифицированных до вида представителей Oligohaeta и Ostracoda. При этом биоценоз Cerastoderma был представлен 30 видами макрозообентоса и во все периоды исследований занимал самые большие площади в собственно Азовском море (Старк, 1960; Некрасова, 1977). Указанное превалирование биоценоза Cerastoderma стало основанием к заключению о возможности «рассматривать весь бентос Азовского моря (без Таганрогского залива), как единый биоценоз Cardium (совр. Cerastoderma), а отдельные единично встречающиеся биоценозы, как его модификации» (Старк, 1960, стр. 171).
Относительно стабильное, хотя и в разных границах, существование основных биоценозов Азовского моря – Cerastoderma и Abra – подтверждается и по результатам более поздних бентосных исследований, выполненных в 1990-е (Золотарев и др., 1995; Студеникина и др., 1998; Любин, 1999; Фроленко, 2000) и 2000-е годы (Набоженко и др., 2006; Терентьев, 2008).
Единая картина чередования биоценозов, состоящих из определённого набора ценозообразующих аборигенных видов, была нарушена после появления в Азовском море дальнеморских вселенцев: в середине 1970-х – Mya arenaria (Савчук, 1980), а в конце 1980-х – Anadara kagoshimensis (Чихачев и др., 1994). Их доминирование в бентосе (с формированием собственного биоценоза) впервые было отмечено: M. arenaria – в 1978 году в районе Бердянской косы (Савчук, 1980), A. kagoshimensis – в 1992 году в районе Казантипского залива (Фроленко, Двинянинова, 1998). Оба вселенца оказались конкурентоспособными, «потеснив» биоценозы аборигенных видов, однако, на период 1989–1995 годов «не внесли заметных устойчивых изменений в структуру и распределение донных сообществ Азовского моря, обогатив лишь её фауну» (Матишов и др., 2008). Тем не менее, в отношении A. kagoshimensis, ситуация в последствии начала меняться. Так, если в 1997 году (Фроленко, Двинянинова, 1998) и 2006 году (Терентьев, 2008), на южном (включая юго-западный) участке моря, происходила сначала устойчивая регистрация биоценоза Anadara наряду с биоценозами аборигенных видов, то уже к 2016–2017 годам было отмечено стабильное (двухлетнее и во все сезоны) монодоминирование A. kagoshimensis в бентосе обширного участка юго-западного сектора Азовского моря (Болтачева и др., 2021). В сформировавшемся здесь биоценозе Anadara ранее основные ценозообразующие виды – церастодерма и абра – выступили в ранге субдоминантов, общий состав макрофауны включал 45 таксонов видового и 6 неидентифицированных до вида групп высокого ранга.
Целью настоящей работы была оценка особенностей трансформации основного аборигенного биоценоза Азовского моря – Cerastoderma в биоценоз вида-вселенца – Anadara.
МАТЕРИАЛ И МЕТОДЫ
Данная работа является продолжением анализа материалов по донной фауне юго-западного участка акватории Азовского моря, полученных в 2016–2017 годы в ходе комплексных гидробиологических экспедиций (84, 86, 90, 96 и 100 рейсы) на НИС «Профессор Водяницкий». В первом сообщении (Болтачева и др., 2021) выполнено описание современного состояния донной макрофауны указанного региона. Для реализации цели в настоящей работе за основу взяты три периода, по которым имеются матрицы данных, позволяющих выполнить сравнительные расчёты на уровне сопоставления одноимённых (или параллельных) биоценозов. Это материалы 1930-х (Воробьев, 1949), 1950-х (Старк, 1960) и 2016–2017 годов (Болтачева и др., 2021). Согласно картографическим данным, представленным в работах этих лет, основными биоценозами на юго-западном участке Азовского моря (полигоне наших исследований) являлись биоценозы Cerastoderma и Abra (1930-е гг.), Cerastoderma (1950-е гг.) и Anadara (2016–2017 гг.).
Биоценозы выделяли по доминирующему по биомассе виду. Кроме этого при сравнении материалов разных лет использованы два варианта оценки количественного развития таксонов:
1) на основе «индекса плотности» (ИП) (Воробьев, 1949);
2) на основе «индекса функционального обилия» (ИФО), являющегося оценочным эквивалентом энергетической роли гидробионтов (Мальцев, 1990).
Приведённые выше индексы использованы в выражениях:
ИП = (Bi×pi)1/2 и ИФО = Ni0.25 × Bi0.75,
где: Bi, Ni и pi – соответственно биомасса (г/м2); численность (экз./м2) и встречаемость (%) таксона «i».
Для многомерного анализа в матрицы включены наиболее значимые виды для соответствующих периодов времени (Воробьев, 1949; Старк, 1960; Болтачева и др., 2021), формирующие, по определению В. П. Воробьева (1949), «ядра» соответствующих биоценозов бентоса. Для основного биоценоза бассейна – Cerastoderma – использованы данные по следующим годам и сезонам (месяцам): 1930-годы (весна, осень (вне заморной зоны и в заморной зоне)), 1950 год (июль), 1951 (апрель, июль, октябрь), 1952 (июль), 1953 (апрель, июль, октябрь), 1954 (апрель, июль, октябрь), 1955 (январь, апрель, июль, октябрь), 1956 (апрель, июль, октябрь), 1957 (апрель, июль, октябрь), 2016 (октябрь, апрель, июнь), 2017 (июль, декабрь). Дополнительно в исходную матрицу включены имеющиеся данные по биоценозу Abra для 1930-х годов (весна и осень).
Выделение относительно однородных группировок бентоса выполнено по результатам 2-D ординации (MDS анализ) log-трансформированной матрицы данных в пакете программ PRIMER v5 (Clarke, 1993; Clarke, Gorley, 2001). В качестве меры сходства станций использован коэффициент сходства Брэя-Куртиса. Определение ценозообразующих видов бентоса выполнено по нетрансформированным значениям ИФО на основе их вклада во внутрикомплексное сходство (SIMPER анализ пакета PRIMER v5) (Clarke, Gorley, 2001).
При сравнении материалов разных лет по ИП использовано их подразделение на весенний и осенний (1930-е и 2016 гг.) и летний (1956 и 2017 гг.) периоды исследований.
К руководящим видам биоценоза («константам» по В. П. Воробьеву) отнесены виды с встречаемостью 50 и более процентов, к характерным («второстепенным») – с встречаемостью 25–50 %, к редким («случайным») – с встречаемостью менее 25 %. Индекс Чекановского-Съеренсена (сходство фаун) вычисляли по формуле:
2а/(b+c),где: а – число общих видов; b и c – число видов в сравниваемых списках.
РЕЗУЛЬТАТЫ
Таксономический состав. Сопоставление видового богатства макрозообентоса в одном из основных биоценозов Азовского моря – биоценозе Cerastoderma на обозначенных промежутках времени (1930-е, 1950-е и 2016–2017 гг.) показывает следующее. В период с 1930-х по 1950-е годы основное количество видов в таксонах Mollusca, Polychaeta и «Прочие виды» – не претерпело существенных изменений, при их значительном сокращении у Crustacea (более чем в 2 раза) (табл. 1). С 1950-х по 2016–2017 годы произошло близкое к двукратному увеличение представленности Mollusca, Polychaeta и «Прочие виды», количество видов Crustacea осталось приблизительно на том же уровне. Кроме данных, представленных в таблице 1, укажем также на аналогичные низкие показатели развития ракообразных в последние годы в южной части Азовского моря, представленные в работах А.С. Терентьева (2008) – 4 вида, Н.М. Литвиненко и О.В. Евченко (2006) – 12 видов.
Таблица 1
Количество видов основных таксономических групп в Азовском море по годам
| Таксон | 1930-е1Все биоценозы | 1930-е1Биоценозы | 19562Биоценоз Cerastoderma | 20153Биоценоз Anadara | 2016–20174(наши данные)Биоценоз Anadara | ||
| Abra | Cerastoderma | суммарно для Abra и Cerastoderma | |||||
| Mollusca | 23 | 6 | 6 | 7 | 7 | 11 | 12 |
| Polychaeta | 34 | 7 | 8 | 8 | 8 | 12 | 15 |
| Crustacea | 60 | 14 | 22 | 23 | 10 | 8 | 13 |
| Other | 19 | 3 | 6 | 6 | 5 | 5 | 10 |
| Всего | 136 | 30 | 42 | 44 | 30 | 36 | 50 |
Примечание к таблице. 1 – по В. П. Воробьеву (1949), 2 – по И. Н. Старк (1960), 3 – по Л. Н. Фроленко и О. С. Мальцевой (2017), 4 – по Н. А. Болтачевой с соавторами (2021).
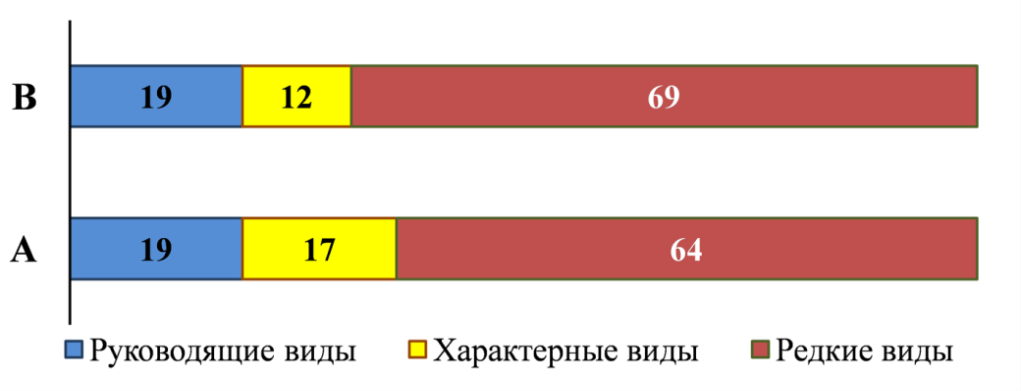
Типизация структуры макрозообентоса по встречаемости видов в двух крайних временных точках нашего исследования (1930-е, биоценоз Cerastoderma и 2016–2017 гг., биоценоз Anadara) показала их сходство (рис. 1). При совпадении доли руководящих видов, и неизменно высокой доле редких видов, в современный период отмечен более высокий уровень относительной представленности таксонов, относимых к группе характерных видов.
Рис. 1. Структура донных биоценозов Азовского моря – Anadara (А) в 2016–2017 годы (наши данные) и Cerastoderma (В) в 1934–1937 годы (Воробьев, 1949) по встречаемости видов
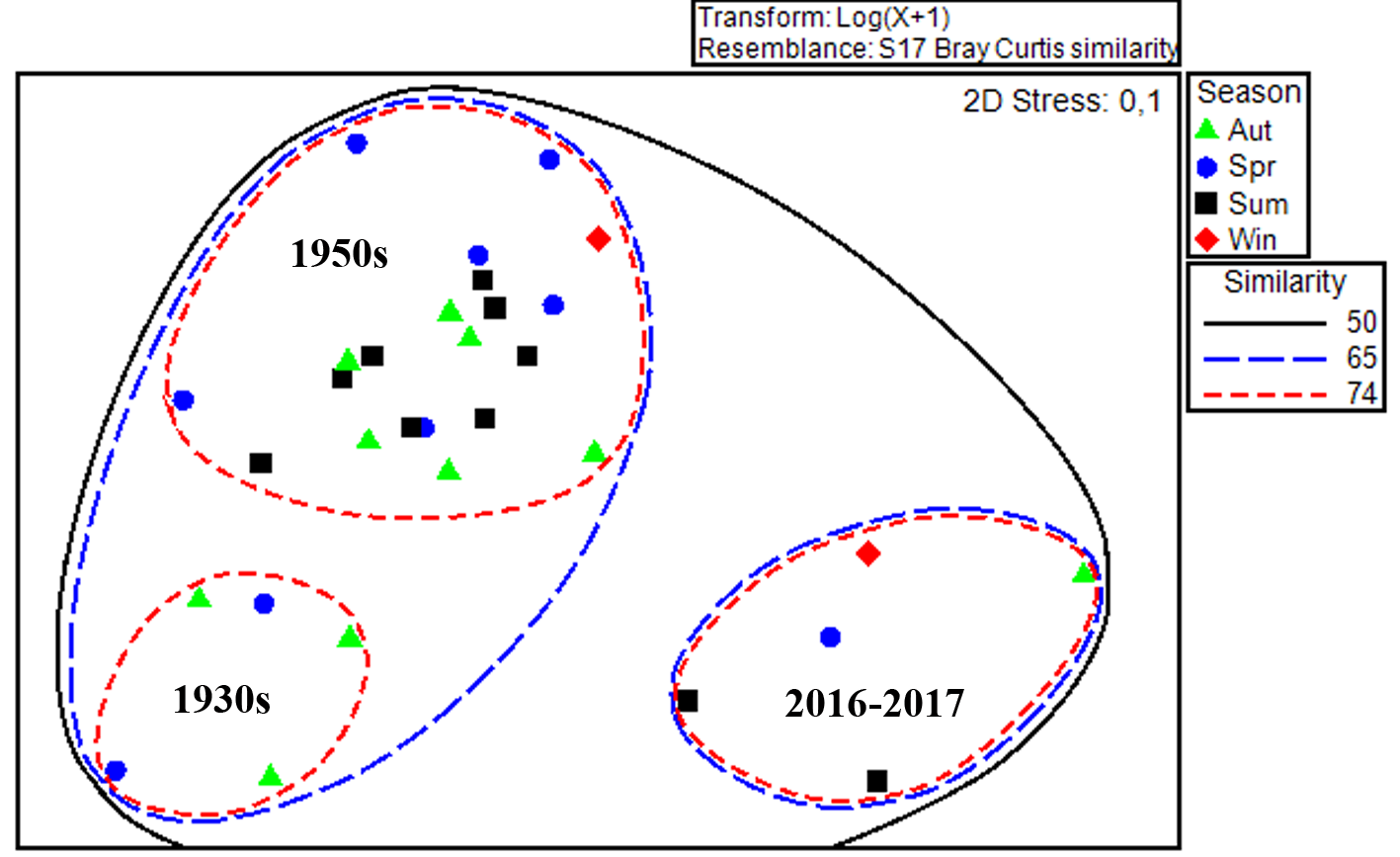
Биоценотическое сходство зообентоса на основе ИФО. Бентос интересующего нас юго-западного участка акватории Азовского моря в разные периоды исследования представлен тремя основными биоценозами – Cerastoderma, Abra и Anadara. При всём разнообразии названий, основанных на доминирующих позициях одного из видов, список основных видов («ядер») биоценозов, приводимый для 1930-х (Воробьев, 1949), 1950-х (Старк, 1960) и 2016–2017 годов (Болтачева и др., 2021), весьма сходен. В нём представлены моллюски Cerastoderma glaucum, Abra segmentum, Hydrobia acuta, Mytilaster lineatus, полихеты Alitta succinea и Nephtys hombergii и усоногий рак Amphibalanus improvisus. Это относительное однообразие доминирующих видов дало высокий уровень биоценотического сходства (более 50 %) (рис. 2). Вне зависимости от сезона съёмок и длины временного ряда по годам, все данные разделились на 3 кластера, представленные десятилетними периодами исследования.
Рис. 2. 2-D ординация данных, полученных в разные сезоны 1930-х (из Воробьев, 1949), 1950-х (из Старк, 1960) и 2016–2017 годов (наши данные, осреднённые по сезонам)
В 1930-е годы в биоценозе Cerastoderma основными комплексообразующими видами были C. glaucum и A. segmentum, на долю которых суммарно приходилось более 90 % вклада во внутрикомплексное сходство (табл. 2). В 1950-е годы, на фоне в целом сохранившегося уровня развития церастодермы, абра теряет свои позиции кодоминанта и переходит в группу видов, в равной степени претендующих на вторую (но далёкую от первой) позицию лидерства. В 2010-е годы, на фоне появившегося нового лидера в бентосе региона и в целом Азовского моря – A. kagoshimensis – позиции как церастодермы, так и абры выглядят ещё более скромно (см. табл. 2).
Многолетняя динамика ИФО. Для упрощения изложения материала при обозначении объекта исследования на временном интервале 1930-е – 2010–2017 годы – будет использован термин биоценоз Anadara/Cerastoderma (биоценоз Anadara и его «исторический» предшественник биоценоз Cerastoderma).
В многолетней динамике биоценоза Anadara/Cerastoderma отмечен отрицательный тренд количественного развития основного комплексообразующего вида C. glaucum по ИФО – его последовательное пропорциональное (в 1,8 раз) снижение с 484 (1930-е) до 276
(1950-е) и 156 (2016–2017 гг.) (см. табл. 2). Многолетняя динамика второго по значимости комплесообразующего вида в биоценозе Cerastoderma 1930-х годов – A. segmentum – сводится к пятикратному снижению её ИФО со 194 (1930-е) до 36 (1950-е) и дальнейшему фактическому сохранению достигнутого уровня ИФО – 40 (2016–2017 гг.). Если судить по сумме ИФО первых 10 наиболее значимых видов, то в эти же годы наблюдалось сначала снижение количественного развития бентоса: с 767 (1930-е) до 456 (1950-е), а после успешного освоения анадарой Азовского моря – повышение до 1020 (2016–2017) (см. табл. 2). Это происходило, в основном, за счёт комплексообразующих видов моллюсков. Без их учёта сумма ИФО остальных видов изменялась с 89 (1930-е) до 143 (1950-е) и 114 (2016–2017). Полученные результаты указывают, что в одном из ведущих биоценозов Азовского моря – биоценозе Anadara/Cerastoderma в 1950-е годы наблюдался наиболее низкий (в сравнении с 1930-ми и 2016–2017 гг.) уровень количественного развития бентоса.
Наиболее благоприятными годами развития A. segmentum и Alitta succinea в биоценозе Anadara/Cerastoderma были 1930-е, когда ИФО данных видов превышал его аналогичные значения в последующие периоды исследования соответственно в 5 и 2–3 раза. Динамика развития A. improvisus в целом повторяет таковую в биоценозе в целом: снижение значения ИФО в 1950-е и достижение максимума – в 2016–2017 годы. Наиболее стабильный уровень значений ИФО на анализируемой шкале времени отмечен у Hydrobia acuta.
Таблица 2
Ранжированный (по вкладу во внутрикомплексное сходство) список основных видов в донных биоценозах Cerastoderma (1930-е и 1950-е гг.) и Anadara (2016–2017 гг.) в разные периоды исследования
| Виды | Ср. ИФО | i | i/SD(i) | i % | Cum. i % |
| 1930-е годы. Среднее сходство: 51,84 | |||||
| Cerastoderma glaucum | 484,33 | 36,90 | 5,61 | 62,79 | 62,79 |
| Abra segmentum | 194,18 | 16,43 | 1,28 | 27,96 | 90,74 |
| Hydrobia acuta | 40,76 | 2,33 | 4,67 | 3,96 | 94,71 |
| Amphibalanus improvisus | 22,61 | 1,09 | 1,77 | 1,85 | 96,56 |
| Alitta succinea | 12,32 | 1,08 | 1,47 | 1,83 | 98,39 |
| Nephtys hombergii | 3,51 | 0,44 | 5,30 | 0,75 | 99,14 |
| Lentidium mediterraneum | 2,93 | 0,22 | 1,52 | 0,37 | 99,51 |
| Ostracoda | 2,89 | 0,18 | 2,64 | 0,30 | 99,81 |
| Brachynotus sexdentatus | 2,18 | 0,07 | 2,34 | 0,11 | 99,92 |
| Ampelisca diadema | 1,35 | 0,03 | 0,58 | 0,06 | 99,98 |
| Mytilaster lineatus | 7,26 | 0,01 | 0,58 | 0,02 | 100,00 |
| 1950-е годы. Среднее сходство: 61,75 | |||||
| Cerastoderma glaucum | 276,29 | 44,21 | 3,12 | 70,96 | 70,96 |
| Hydrobia acuta | 35,99 | 3,57 | 1,20 | 5,74 | 76,69 |
| Ostracoda | 23,48 | 3,34 | 1,23 | 5,35 | 82,05 |
| Amphibalanus improvisus | 17,80 | 2,84 | 1,72 | 4,55 | 86,60 |
| Abra segmentum | 36,34 | 2,19 | 0,71 | 3,51 | 90,11 |
| Mytilaster lineatus | 15,64 | 2,12 | 1,12 | 3,41 | 93,52 |
| Lentidium mediterraneum | 32,65 | 1,42 | 0,52 | 2,28 | 95,80 |
| Nephtys hombergii | 8,43 | 1,34 | 2,99 | 2,15 | 97,94 |
| Oligochaeta | 5,33 | 0,80 | 1,18 | 1,28 | 99,22 |
| Alitta succinea | 3,63 | 0,48 | 1,42 | 0,78 | 100,00 |
| 2010-е годы. Среднее сходство: 67,49 | |||||
| Anadara kagoshimensis | 711,25 | 38,52 | 1,20 | 75,14 | 75,14 |
| Cerastoderma glaucum | 156,47 | 6,78 | 0,78 | 13,23 | 88,37 |
| Amphibalanus improvisus | 25,20 | 1,50 | 1,32 | 2,92 | 91,29 |
| Abra segmentum | 39,51 | 1,34 | 0,94 | 2,62 | 93,91 |
| Nephtys hombergii | 14,22 | 1,16 | 5,22 | 2,27 | 96,17 |
| Ostracoda | 23,27 | 1,07 | 1,17 | 2,08 | 98,25 |
| Alitta succinea | 6,26 | 0,45 | 2,27 | 0,88 | 99,13 |
| Hydrobia acuta | 38,43 | 0,24 | 0,41 | 0,46 | 99,60 |
| Oligochaeta | 2,43 | 0,12 | 0,95 | 0,23 | 99,82 |
| Mytilaster lineatus | 2,80 | 0,09 | 1,38 | 0,17 | 99,99 |
| Mya arenaria | 1,64 | 0,01 | 0,26 | 0,01 | 100,00 |
Примечание к таблице. Ср. ИФО – среднее значение индекса функционального обилия; – абсолютный и i % – относительный вклады вида «i» в среднее сходство Брэя–Куртиса внутри комплекса; SD – стандартное отклонение.
Многолетняя динамика ИП. Приводимый в работах В. П. Воробьева (1949) и И. Н. Старк (1960) табличный и графический материалы позволили сопоставить количественное развитие биоценоза Anadara/Cerastoderma на основе ИП: 1930-е и 2016 годы в весенний и осенний периоды, 1956 и 2017 годы – в летний период.
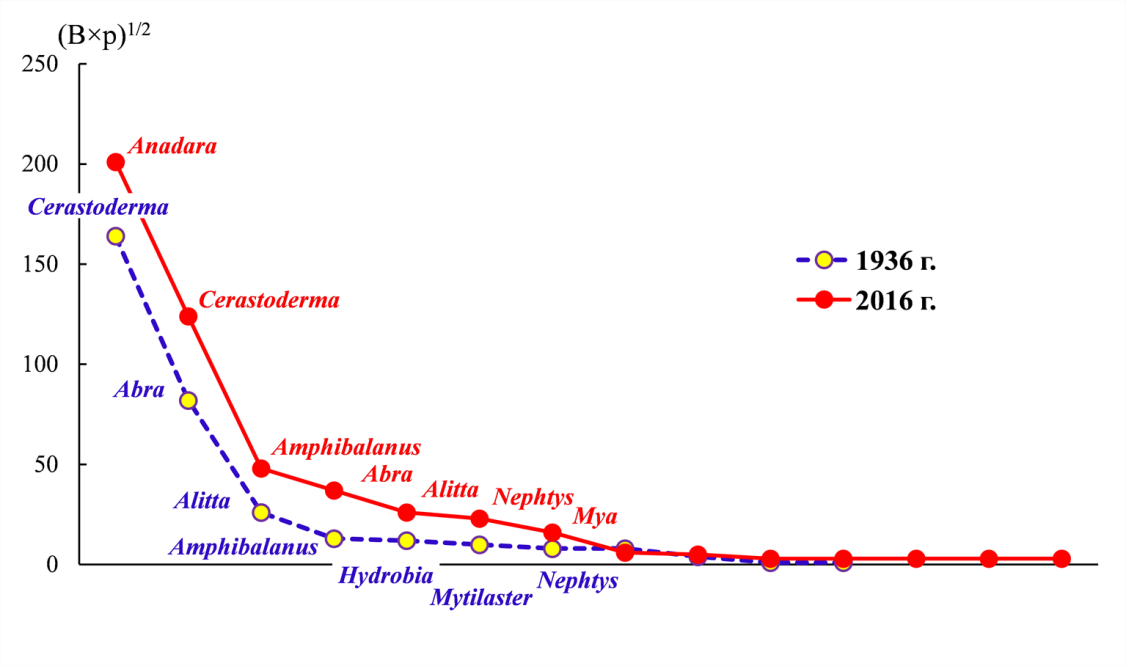
Весной 1936 года в биоценозе Cerastoderma абсолютным доминантом по ИП была C. glaucum, субдоминантом – Abra segmentum (рис. 3). Высокие показатели ИП также были отмечены у полихеты Alitta succinea и усоногого рака A. improvisus. В число второстепенных видов входили моллюски H. acuta, Mytilaster lineatus и полихета N. hombergii (см. рис. 3). В 2016 году руководящим видом в сообществе стала A. kagoshimensis, C. glaucum перешла в положение субдоминанта с ИП=124 (в 1936 г. ИП=164). На третьем месте – A. improvisus с ИП=48 (в 1936 г. ИП=13), что, видимо, связано с увеличением количества субстрата (раковины самой A. kagoshimensis) для прикрепления A. improvisus. A. segmentum стало меньше, а у полихет A. succinea и N. hombergii высокие показатели индекса плотности сохранились. В число второстепенных форм вошел вселенец Mya arenaria. H. acuta и M. lineatus, не исчезли, но перешли в число второстепенных видов; их индекс плотности снизился с 12 и 5, соответственно, до 5 и 3. Таким образом, структура весеннего биоценоза Anadara в 2016 году отличалась от таковой биоценоза Cerastoderma 1930-х годов только наличием A. kagoshimensis, все «постоянные» и «второстепенные» виды не только присутствовали, но их количественные соотношения и последовательность расположения на кривых доминирования-разнообразия были сходными.
Рис. 3. Кривые рангового распределения видов (по ИП) в биоценозах Anadara (весна 2016 г.) и Cerastoderma (весна 1936 г., из (Воробьев, 1949))
Приведены родовые названия видов, под Abra подразумевается Abra segmentum, остальные рода представлены одним видом, их полные названия приведены в тексте.
Осенью 1936 года в биоценозе Cerastoderma доминирующими видами оставались C. glaucum и A. segmentum, однако структура сообщества в районах, подвергнувшихся летом замору, отличалась от таковой в районах вне замора (рис. 4). C. glaucum резко доминировала над A. segmentum там, где замора не было. Среди второстепенных видов выделялись A. improvisus, M. lineatus, A. succinea. В районах, где произошел замор, C. glaucum и A. segmentum выравнивались по биомассе и индексу плотности, а по численности A. segmentum даже превышала C. glaucum. На первый план среди второстепенных видов выходили формы более выносливые к дефициту кислорода – H. acuta и N. hombergii.
Рис. 4. Кривые рангового распределения видов (по ИП) биоценозов Anadara (осень 2016 г.) и Cerastoderma (осень 1936 г., из (Воробьев, 1949))
Приведены родовые названия видов, под Abra подразумевается Abra segmentum, остальные рода представлены одним видом, их полные названия приведены в тексте.
Осенью 2016 года доминирующим видом в биоценозе была анадара, в число второстепенных – входили N. hombergii, A. improvisus, A. succinea, а также полихеты—вселенцы P. cornuta и S. gynobranchiata. Церастодерма и абра обнаружены были либо в крайне малых количествах (C. glaucum), либо в виде преимущественно молоди (A. segmentum). Следует отметить, что в предшествующее время, в июне 2016 года, на этом же полигоне численность и биомасса C. glaucum и A. segmentum были достаточно велики (345 и 170 экз./м2, 149,3 и 18,2 г/м2 соответственно) с встречаемостью обоих видов – 100 % (Болтачева и др., 2021). Можно предположить, что в конце лета 2016 года на исследуемом участке акватории создались кислород-дефицитные (заморные) условия, что привело к отмиранию менее устойчивых к этим условиям форм – C. glaucum и A. segmentum, а A. kagoshimensis благополучно перенесла этот период. Летом 2017 года субдоминантом в биоценозе анадары вновь стала церастодерма, абра также возвратилась в состав характерных видов.
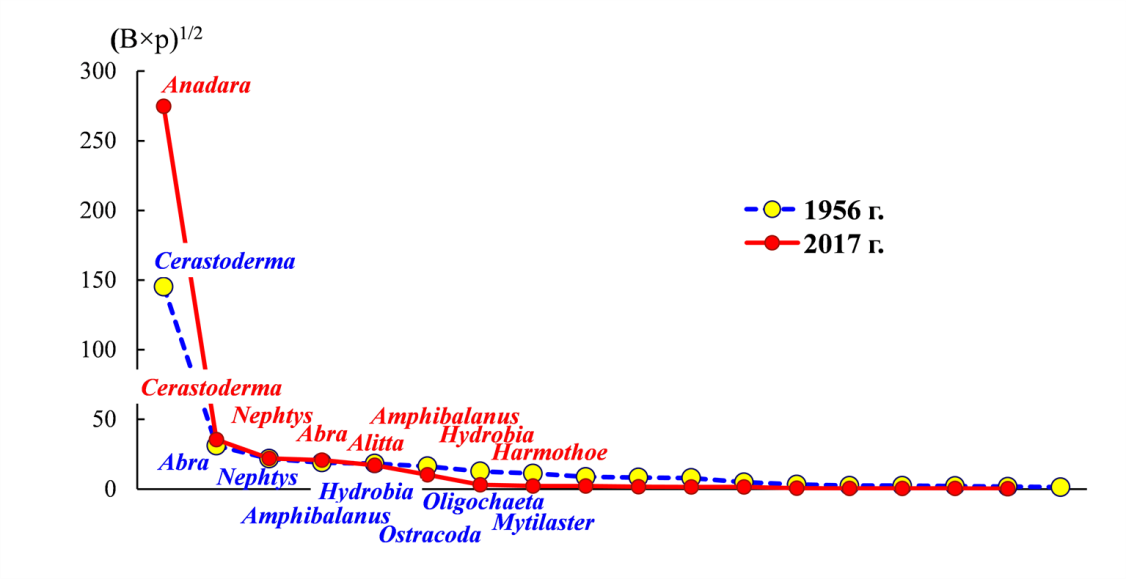
Сопоставление доступных данных для летней серии наблюдений указывает на то, что структура биоценоза Anadara 2017 года, близка к таковой биоценоза Cerastoderma 1956 года (рис. 5). Из шести видов, входивших в 1956 году в ядро биоценоза Cerastoderma, пять входили в ядро биоценоза Anadara и в 2017 году, M. lineatus перешел в состав второстепенных видов, A. succinea, напротив, вошла в число руководящих форм (в 1956 г. была в числе второстепенных).
В многолетнем ряду наблюдений суммарный ИП первых 10-ти наиболее значимых видов в биоценозе Anadara/Cerastoderma снижается почти в 2 раза с 774 (1930-е гг.) до 478 (1950-е). Дальнейшее поведение суммарного значения ИП оказалось в большой степени зависимым от появления в бентосе A. kagoshimensis. Без её учёта отмечено продолжение снижения суммарного ИП, упавшего к 2016–2017 годам до 189. Иная картина складывается при учёте A. kagoshimensis: суммарный ИП 10-ти наиболее значимых видов в 2016–2017 годы уже превышает уровень развития бентоса 1930-х в 1,3 раза.
Многолетняя динамика биомассы. Сравнение количественного развития макрозообентоса в 1936 и 2016 годы показало, что в весеннее время в 2016 году биомасса церастодермы была достаточно велика (154 г/м2), но в 1,7 раз ниже, чем в 1936 году (270,1 г/м2). Однако за счет появления анадары (406 г/м2) биомасса биоценоза в целом была выше в
Рис. 5. Кривые рангового распределения видов (по ИП) в биоценозах Anadara (лето 2017 г.) и Cerastoderma (лето 1956 г., по (Старк, 1960))
Приведены родовые названия видов, под Abra подразумевается Abra segmentum, остальные рода представлены одним видом, их полные названия приведены в тексте.
1,5 раза. Показатели биомассы бентоса в биоценозе анадары осенью 2016 года были более близки к показателям биоценоза церастодермы 1936-го года вне заморного района (686,1 и 845,6 г/м2 соответственно), при этом на долю анадары, в первом случае, приходилось 96 % всей биомассы биоценоза. В конце осени-начале зимы 2017 года биомасса бентоса достигла 1501 г/м2, превысив показатели 1936 года в 1,8 раз, с сохранением доли A. kagoshimensis в 96 % в его общей биомассе (Болтачева и др., 2021).
Летом 1956 года, средняя биомасса бентоса в биоценозе Cerastoderma составляла 252,8 г/м2 (вклад церастодермы – 83 %, 210,9 г/м2) (Старк, 1960). Летом 2016 года биомасса бентоса в биоценозе анадары достигала 734 г/м2 (при доле A. kagoshimensis 74 %), из них 149 г/м2 приходилось на C. glaucum (с долей в общей биомассе бентоса 20 %). Таким образом, количественные показатели развития церастодермы для этих двух периодов близки, но за счет анадары общая биомасса бентоса в 2016 году в 2,9 раз выше, чем в 1956 году. Сравнение средней биомассы бентоса (для собственно Азовского моря) в 1930-е и в 1950-е годы показало, что почти во все годы и сезоны в 1950-е годы биомасса была существенно ниже, чем в 1930-е годы. Исключение составляли лишь апрель 1956 и 1957 годов, когда биомасса была выше, чем в 1934 году (Старк, 1960).
ОБСУЖДЕНИЕ
Подробный анализ факторов, определяющих количественное развитие, состав и структурные характеристики (биоценотическую организацию) зообентоса Азовского моря содержится в работе В. П. Воробьева (1949). К основным из них отнесены 1) количественное распределение пищи, 2) рельеф дна и распределение грунтов, 3) течения и перемещения водных масс, 4) температурный режим, 5) газовый режим, 6) солевой режим, 7) биологические особенности организмов и 8) биоценотические связи организмов. Комплексный анализ указанных основных факторов позволил В.П. Воробьеву описать основные закономерности формирования и распределения бентоса Азовского моря. Фактически эти же факторы в той или иной степени отвечают и за формирование многолетних изменений донной экосистемы Азовского моря, пожалуй, с одним добавлением – необходимостью учёта фактора «инвазии» (фактора появления новых элементов фауны, способных приводить к изменениям в составе аборигенных видов и образуемых ими биоценозов). Рассмотрим основные изменения, которые представлены нами в рамках анализа многолетних данных, и сопоставим эти изменения с возможными факторами их определяющими.
Таксономический состав. В период с 1930-х по 2016–2017 годы в биоценозе Anadara/Cerastoderma отмечены изменения видового богатства основных таксономических групп: 1950-е и 2016–2017 годы были беднее 1930-х по группе ракообразных, а 2016–2017 годы – богаче 1930-х и 1950-х по группам моллюсков, полихет и прочим видам. В отношении отмеченного сокращения количества регистрируемых видов ракообразных мы присоединяемся к уже сложившемуся мнению о влиянии на данный процесс роста солёности вод (Некрасова, 1972; Закутский и др., 1978; Фроленко, 2000), поскольку значительное количество азовоморских Crustacea относятся к олигогалинным видам (Мордухай-Болтовской, 1960). Несмотря на колебательный характер солёности вод Азовского моря, включающий периоды распреснения и осолонения бассейна (Дашкевич и др., 2014), в анализируемых нами трёх периодах наблюдений прослеживается чёткий положительный тренд изменения солёности: 9,3–11,1 ‰ (1931–1937 гг.), 11,6–12,1 ‰ (1950–1957 гг.) и 13,5–14 ‰ (2016–2017 гг.) (Бердников, 2006; Кочергин и др., 2018; наши данные). Отмеченное (в этом ряду) повышение солёности до 11,6 ‰ и выше – явилось критическим для развития некоторых олигогалинных форм ракообразных. Однако, не следует упускать из вида и вариант биоценотических перестроек, связанных с изменением степени заиленности субстрата и замещением эпифаунных биоценозов, в которых обильно представлены ракообразные, на биоценозы с превалированием инфауны (Старк, 1951).
Современное увеличение видового богатства в группах моллюсков, полихет и прочих видов отчасти связано с повышением солёности, обусловившим благоприятные условия для проникновения и развития в Азовском море ближнеморских вселенцев. Известно, что периодическое увеличение солёности бассейна приводило к появлению здесь, а более всего – в прикерченском районе, некоторых черноморских форм бентоса. Это отмечалось на пиках солёности (более 13 ‰) в 1970-е годы (Закутский и др., 1978; Литвиненко, Евченко, 2006). Но появление ряда дальнеморских видов-вселенцев (эвригалинных или солоноватоводных) явилось результатом интенсификации судоходства, развития марикультуры (Болтачева и др., 2021).
Среди общих закономерностей многолетнего изменения экосистемы Азовского моря следует отметить тенденцию увеличения степени обогащения донных отложений органическим веществом. Его концентрация в осадках 2007–2013 годов возросла по сравнению с 1980–1987 годами в 1,5–1,9 раз (Александрова и др., 2014). В таких условиях появление дополнительных потребителей органического вещества – детритофагов, в лице видов-вселенцев сем. Spionidae, может способствовать более полному усвоению избытка доступной органики в донных отложениях Азовского моря. Представитель этого семейства – Polydora cornuta – распространился по всему Азовскому морю, а в юго-западной части вошел в число руководящих видов биоценоза Anadara с встречаемостью 84 % и плотностью до 1014 экз./м2 (в среднем 154 экз./м2). Натурализация других спионид вселенцев в Азовское море – Streblospio gynobranchiata и Marenzelleria neglecta, видимо, еще не завершена, однако они зарегистрированы во всех частях собственно Азовского моря (Лисицкая, Болтачева, 2016; Фроленко, Мальцева, 2017; Syomin et al., 2017; Болтачева, Лисицкая, 2019). В наших осенних сборах 2016 года численность S. gynobranchiata достигала 2316 экз./м2. Перечисленные представители сем. Spionidae являются эврибионтными видами-оппортунистами, выносливыми к понижению содержания кислорода и к высокому уровню эвтрофирования (Radashevsky, Selifonova, 2013).
Количественное развитие зообентоса и солёность. Несомненно, что фактор солёности является одним из определяющих и в количественной динамике развития отдельных видов, как и зообентоса в целом. Снижение развития C. glaucum, как и аборигенного комплекса видов зообентоса в целом, отмечаемые нами на фоне роста солёности в 1930-е, 1950-е и 2016–2017 годы, подтверждаются данными других исследователей (Воробьев, 1949; Некрасова, 1977).
Хотя C. glaucum и является типичным эвригалинным организмом с диапазоном границ солёности 2,5–42 ‰ (Карпевич, 1955, цит. по Старк, 1960), но в Азовском море её наибольшее развитие приурочено к акваториям с малой солёностью – 7–10 ‰ (Воробьев, 1949). М. Я. Некрасова (1977), по результатам анализа материалов 1953–1974 годов, в Азовском море выделяла два типа донных биоценозов, сменяющих друг друга в годы низкой и высокой солености вод. В годы низкой солености (10–11,5 ‰) наблюдалась высокая биомасса бентоса – в среднем 280 г/м2, с массовой долей C. glaucum, равной 69,5 %, и A. segmentum – 13,2 %. В годы повышенной солености (12–12,5 ‰) биомасса бентоса снижалась до 225 г/м2. Это происходило за счет большинства видов, однако особенно большое снижение наблюдалось у A. segmentum – до 18,6 г/м2 (8,7 % от общей биомассы); площади биоценозов C. glaucum и A. segmentum при этом уменьшались (Некрасова, 1977). Для периода 1991–2005 годов показана отрицательная связь между средней биомассой C. glaucum и изменением солёности собственно Азовского моря (Гаркопа, Сарвилина, 2011). Однако, следует обратить внимание на то, что не само снижение солёности в годы многоводных рек, а повышенное поступление в бассейн биогенных элементов и взвешенной органики – могло являться фактором, усиливающим развитие фильтраторов-сестонофагов, каким, например, является C. glaucum (Старк, 1960).
В целом, однако, предполагается (Матишов и др., 2008), что за период с 1933 по 2000-е годы колебания солёности не изменили решающим образом распределение бентосных сообществ Азовского моря. Повышение его солёности приводило к некоторому увеличению биомассы и изменению площадей распространения фоновых аборигенных видов, но не определяло коренных перестроек в характере распределения донных сообществ. Таким образом, вплоть до конца 2000-х годов, в Азовском море сохранялся единый «моллюско-балянусовый биоценоз» (по Воробьеву) или «биоценоз Cardium» (по Старк).
Появление в Азовском море в 1989 году эмигранта из Чёрного моря (A. kagoshimensis) – нарушило эту «стабильность». Уже к 2016–2017 годам развитие зообентоса, оцениваемое по суммарному ИФО первых 10 наиболее значимых видов, за счёт анадары в 1,3 раза превышало, а по уровню биомассы – было сопоставимо или превышало аналогичные параметры развития биоценоза 1930-х годов. Освоение новых площадей и увеличение биомассы этого нового вселенца определялись его высокими адаптационными возможностями к новым условиям обитания (Ревков, Щербань, 2017), включая положительную реакцию на повышение солёности (Живоглядова и др., 2021). Так в годы опреснения Азовского моря (2000–2006 гг.), когда средняя солёность водоёма составляла менее 10 ‰, было отмечено снижение количественного развития анадары и уменьшение площади ее биоценоза, который обнаруживался лишь в отдельные сезоны (Фроленко, 2006; Набоженко и др., 2006; Фроленко, Мальцева, 2017). С 2007 года, на фоне роста среднегодовой солёности моря до уровня 13,37‰ в 2015 году, отмечены устойчивые тенденции расширения ареала, включая проникновение в Таганрогский залив (Фроленко, Мальцева, 2017), и увеличения общих запасов анадары в Азовском море к 2018 году до 15 млн. тонн (Живоглядова и др., 2021).
По итогам сопоставления количественного развития зообентоса и уровня солёности вод следует обратить внимание на следующее. Отмеченная нами динамика снижения количественного развития аборигенного комплекса видов соотносится не со шкалой времени в целом, а с определёнными периодами наблюдения (1930-е, 1950-е и 2016–2017 гг.), в которых солёность бассейна представлена, как отмечено ранее, по нарастающей (соответственно 9,3–11,1 ‰, 11,6–12,1 ‰ и 13,5–14 ‰). Не только биомасса биоценоза церастодермы, но и средняя биомасса бентоса в собственно Азовском море в 1950–1955 годы были существенно ниже, чем в 1930-е годы. В весеннее время она составляла от 35 до 82 % значения этого показателя в 1930-е годы, в осеннее – 51–66 % (Старк, 1960). Лишь осенью 1957 года средняя биомасса бентоса достигла уровня 95 % от биомассы в 1930-е годы. Это повышение авторы связывали со снижением (относительно начала 1950-х гг.) уровня солености вод в 1956–1957 годы (Спичак, 1960; Старк, 1960). В другие периоды наблюдения, в связи с многолетним характером флуктуаций солёности Азовского моря, на этой же шкале (1930-е – 2016–2017 гг.) в годы понижения солёности бассейна были отмечены периоды усиления развития аборигенного комплекса видов. Так, в 2004 году в период снижения солёности Азовского моря до 9–11 ‰ (Кочергин и др., 2018) на его юго-западном участке было отмечено увеличение биомассы руководящего вида биоценоз C. glaucum до 1 и более кг/м2 (Набоженко и др., 2006). На тот момент A. kagoshimensis была представлена в бентосе исключительно молодью, что дало основание отнести её к «постоянно флуктуирующим временным субдоминантам» сообщества Cerastoderma–Hydrobia–Amphibalanus (Набоженко и др., 2006).
Многолетняя динамика бентоса и кислородный режим. Другим важным гидрохимическим фактором, определяющим развитие бентоса, является кислородный режим придонных горизонтов. Его действие в основном ассоциируется с формированием периодических сезонных (летних) заморов донной фауны Азовского моря, приводящих к изменениям в распределении бентосных сообществ (Воробьев, 1949; Старк, 1960; Фроленко, Семиглазова, 1998; Студеникина и др., 1998; Матишов и др., 2008). Основные ценозообразующие виды бассейна – C. glaucum и A. segmentum – имеют разную чувствительность к придонной гипоксии. Первый – «стенооксигенный», второй – вынослив к кратковременному дефициту кислорода и может до 5–8 дней находиться в анаэробных условиях (Воробьев, 1949). Периодические заморы донной фауны и сероводородное заражение грунтов на обширных участках Азовского моря приводят к снижению численности и биомассы церастодермы, уменьшению площадей, занятых ее биоценозом (Студеникина и др., 1998; Александрова и др., 2014). Так, площадь биоценоза церастодермы снизилась с 31–38 % в 1930-е годы (Воробьев, 1949) до 4–11 % в 1996–1997 годы (Фроленко, Семиглазова, 1998). Резкое сокращение биомассы церастодермы осенью 2016 года, по сравнению с весной и началом лета 2016 года (в 34–35 раз), в юго-западной части Азовского моря произошло, предположительно, именно в результате развития гипоксии в летнее время (Болтачева и др., 2021). При этом биомасса анадары возросла в 2016 году в 1,2 раза, а в 2017 году – в 1,9 раз. Физиолого-биохимические особенности, присущие A. kagoshimensis (наличие эритроцитарного гемоглобина и др.), позволяют ей существовать в условиях гипоксии (Андреенко и др., 2009) даже в сочетании с сероводородным заражением среды (Головина, 2019). Последнее является фактором, повышающим конкурентоспособность анадары, по отношению к аборигенным видам зообентоса при возможном сезонном усилении кислород-дефицитных условий в Азовском море.
Межгодовую динамику кислородной депрессии определяют многие факторы – изменение температурного фона, ветровая активность, изменение объёма стока рек и первичной продукции (Александрова, 2012). Известно, что площадь дна с дефицитом кислорода (насыщение кислородом <60 %) увеличивалась, в среднем с 8 (1960–1987 гг.) до 14 тыс. км2 (1988–2008 гг.), при распространении депрессии кислорода с высокой повторяемостью на 50–90 % площади Азовского моря (Александрова, 2012). В связи с этим, в условиях стабильного (с середины 1980-х гг.) повышения среднегодовой температуры вод Азовского моря (Дашкевич, Бердников, 2008), при ослаблении ветрового режима, определяющего вертикальное перемешивание вод, в летнее время серьёзно усиливается угроза формирования обширных гипоксических/аноксических зон и замора донной фауны. В таком случае можно ожидать снижение количественного развития оксифильных форм бентоса и дальнейшего распространения анадары в донных биоценозах.
Трансформация биоценоза. В бентосе юго-западного участка Азовского моря к 2016–2017 годам мы констатируем формирование единого биоценоза Anadara, который «поглотил» (объединил) ранее существовавшие в данном регионе биоценозы аборигенных видов. Последние остались представленными в биоценозе Anadara субдоминантами в соответствующих биоценотических комплексах (Болтачева и др., 2021). Причина отмеченной трансформации биоценозов очевидна и заключается в сверхуспешном освоении A. kagoshimensis акватории Азовского моря и её абсолютном количественном доминировании в зообентосе региона.
Идея большого сходства состава донной фауны Азовского моря и возможность формального объединения некоторых аборигенных биоценозов в единый биоценоз рассматривалась и ранее. Так, по мнению В. П. Воробьева (1949), с точки зрения общности видов, бентос большей части собственно Азовского моря в 1930-е годы мог быть представлен в виде единого «смешанного» моллюско-балянусового биоценоза. При более жёстком подходе к критериям понятия биоценоз («наличие определённой структуры и количественных соотношений между видами, его (биоценоз) составляющими») эта «смешанная» структура была разбита на отдельные биоценозы, названные по доминирующим в них видам. Биоценоз Cerastoderma (=Cardium) В. П. Воробьев (1949) рассматривал, как проявление «пяти постоянно встречающихся комплексов». В этих комплексах руководящими видами в паре с церастодермой выступали весной и осенью пять общих видов, формирующих «ядро» биоценоза Cerastoderma – абра (=синдесмия), балянус, нереис, гидробия, митилястер. Доминируя в своём развитии над другими формами бентоса, церастодерма в данном случае выступала в качестве вида-объединителя различных (по видам-субдоминантам) биоценотических комплексов.
Биоценоз Anadara в 2016–2017 годы – это фактически тот же биоценоз Cerastoderma предыдущих лет, только с другим (новым) лидером – A. kagoshimensis. Трансформация биоценоза Cerastoderma в биоценоз Anadara произошла в результате добавления нового вида-доминанта без явных изменений в самой структуре «ядра» биоценоза. Ранее существовавший на большой площади юго-западного участка Азовского моря биоценоз Cerastoderma – преобразовался в биоценоз Anadara.
ЗАКЛЮЧЕНИЕ
В настоящее время в фазе осолонения вод на значительной площади дна юго-западной части Азовского моря наиболее широко распространенный ранее биоценоз двустворчатого моллюска Cerastoderma glaucum трансформировался в биоценоз другого двустворчатого моллюска – Anadara kagoshimensis, с сохранением «ядра» видов прежнего биоценоза. Причина подобной трансформации заключается в исключительно успешном освоении анадарой акватории Азовского моря и превращении её в доминирующий вид в бентосе региона. Можно предположить, что дальнейшая экспансия последней в Азовском море (в условиях сохранения уровня солёности бассейна) – может привести к трансформации других аборигенных биоценозов в биоценоз Anadara на более обширных площадях бассейна.
В многолетнем ряду наблюдений, включающем периоды 1930-х, 1950-х и 2016–2017 годов, на фоне роста (в рамках этих периодов) солёности Азовского моря, отмечено снижение показателей количественного развития аборигенного комплекса видов. В 2016–2017 годы, за счёт развития Anadara kagoshimensis, зарегистрировано «компенсаторное» увеличение суммарной биомассы зообентоса, превышающей таковую 1930-х годов.
Современное увеличение видового богатства в группах Mollusca, Polychaeta и «Прочие виды», с нашей точки зрения, связано с повышением солёности (в 2016 году его уровень превысил в среднем 13,5 ‰) способствующим понтизации фауны Азовского моря, а также с интенсификацией судоходства и развитием марикультуры, которые привели к появлению ряда дальнеморских видов-вселенцев. В условиях возрастающего обогащения донных осадков органическим веществом, появление и распространение в Азовском море чужеродных видов детритоядных полихет сем. Spionidae – будет способствовать более полному усвоению избытка органики и снижению угрозы сероводородного загрязнения.
Работа выполнена в рамках государственного задания ФГБУН ИМБИ по темам: «Закономерности формирования и антропогенная трансформация биоразнообразия и биоресурсов Азово-Черноморского бассейна и других районов Мирового океана» (№ гос. регистрации 121030100028-0).
REFERENCES
Александрова З. В. Многолетняя изменчивость кислородного режима и содержания биогенных веществ в Азовском море // Основные проблемы рыбного хозяйства и охраны рыбохозяйственных водоемов Азово-Черноморского бассейна. Ростов-на-Дону: ФГУП АзНИИРХ, 2012. – С. 18–35.
Александрова З. В., Баскакова Т. Е., Шевцова Е. А., Долженко С. В. Основные закономерности развития гипоксии в придонном слое Азовского моря и ее экологические последствия для гидробионтов // Основные проблемы рыбного хозяйства и охраны рыбохозяйственных водоемов Азово-Черноморского бассейна. Ростов-на-Дону: ФГУП АзНИИРХ, 2014. – С. 11–32.
Андреенко Т. И., Солдатов А. А., Головина И. В. Адаптивная реорганизация метаболизма у двустворчатого моллюска Anadara inaequivalvis Bruguiere в условиях экспериментальной аноксии // Доповіді НАН України. – 2009. – № 7. – С. 155–160.
Бердников С. В. Моделирование крупномасштабных изменений океанологических характеристик экосистемы Азовского моря // Закономерности экосистемных процессов в Азовском море, ЮНЦ РАН. – М.: Наука, 2006. – С. 137–229.
Болтачева Н. А., Лисицкая Е. В. Полихеты юго-западной части Азовского моря // Экосистемы. – 2019. – Вып. 19 (49). – С. 133–141.
Болтачева Н. А., Ревков Н. К., Надольный А. А., Аннинская И. Н. Донная фауна юго-западной части Азовского моря: Таксономический состав и биоценотическая организация макрозообентоса в 2016–2017 годах // Морской биологический журнал. – 2021. (в печати).
Воробьев В. П. Бентос Азовского моря. Труды АзЧерНИРО. – Симферополь: Крымиздат, 1949. – Вып. 13. – 193 с.
Гаргопа Ю. М., Сарвилина С. В. Климатические изменения зообентоса Азовского моря в условиях антропогенного воздействия // Водные ресурсы. – 2011. – Т. 38, № 6. – С. 698–706.
Головина И. В. Устойчивость к негативным воздействиям и соотношение активности ферментов энергетического обмена в тканях черноморских моллюсков Mytilus galloprovincialis Lamarck, 1819 и Anadara kagoshimensis (Tokunaga, 1906) // Морской биологический журнал. – 2019. – Т. 4, № 3. – С. 37–47. DOI: 10.21072/mbj.2019.04.3.04
Дашкевич Л. В., Бердников С. В. Математическое моделирование температурного режима и тепловой баланс Азовского моря // Экологический вестник научных центров Черноморского экономического сотрудничества. – 2008. – № 4. – С. 5–18.
Дашкевич Л. В., Кулыгин В. В., Бердников С. В. Многолетнее изменение средней солености Азовского моря: данные наблюдений и модельный расчет // Экология. Экономика. Информатика (7–12 сентября 2014) Сборник статей в 2 т. Южный федеральный университет: Издательство Южного федерального университета. – Ростов-на-Дону, 2014. Том 1: Системный анализ и моделирование экономических и экологических систем. – С. 175–182.
Живоглядова Л. А., Ревков Н. К., Фроленко Л. Н., Афанасьев Д. Ф. Экспансия двустворчатого моллюска Anadara kagoshimensis (Tokunaga, 1906) в Азовском море // Российский журнал биологических инвазий. – 2021. – № 1. – С. 83–94.
Закутский В. П., Алдакимова А. Я., Толоконникова Л. И., Губина Г. С., Копец В. А., Некрасова М. Я. Изменение планктона и бентоса Азовского моря в условиях антропогенного воздействия // Гидробиологический журнал. – 1978. – Т. 14, № 1. – С. 28–34.
Золотарев П. Н., Литвиненко H. M., Терентьев A. C. Исследования структуры донного сообщества западной части Азовского моря с помощью метода биоиндикации экологических аномалий в бентали морских водоемов // Труды южного научно-исследовательского института морского рыбного хозяйства и океанографии. – 1995. – Т. 41. – С. 68–71.
Кочергин А. Т., Жукова С. В., Малыгин Е. Ю. Межгодовая изменчивость солености и вертикальной термохалинной устойчивости в различных районах Азовского моря в летний период 1992–2016 гг. // Системы контроля окружающей среды. – 2018. – Вып. 31. – С. 63–68.
Лисицкая Е. В., Болтачева Н. А. Полихеты, вселившиеся в азово-черноморский бассейн в конце 20 – начале 21 века // Окружающая среда и человек. Современные проблемы генетики, селекции и биотехнологии: Материалы Международной научной конференции и молодежной научной конференции (Ростов-на-Дону, Россия, 5–8 сентября 2016 г.). – Ростов-на-Дону, 2016. – С. 211–213.
Литвиненко Н. М., Евченко О. В. Изменение качественного и количественного состава зообентоса Азовского моря после зарегулирования реки Дон // Современные проблемы экологии Азово-Черноморского бассейна: Материалы II Международной конференции (Керчь, ЮгНИРО, 26–27 июня 2006 г.). – Керчь: Изд-во ЮгНИРО, 2006. – С. 36–41.
Любин П. А. Зообентос Азовского моря // Современное развитие эстуарных экосистем на примере Азовского моря. – Апатиты: КНЦ РАН, 1999. – С. 167–194.
Мальцев В. И. О возможности применения показателя функционального обилия для структурных исследований зооценозов // Гидробиологический журнал. – 1990. – Т. 26, № 1. – С. 87–88.
Матишов Г. Г., Шохин И. В., Набоженко М. В., Польшин В. В. Многолетние изменения донных сообществ Азовского моря в связи с характером осадконакопления и гидрологическим режимом // Океанология. – 2008. – Т. 48, № 3. – С. 425–435.
Мордухай-Болтовской Ф. Д. Каталог фауны свободноживущих беспозвоночных Азовского моря // Зоологический журнал. – 1960. – Т. 39, № 10. – С. 1454–1465.
Набоженко М. В., Шохин И. В., Сарвилин С. В., Коваленко Е. П. Современное состояние макрозообентоса Азовского моря // Вестник Южного научного центра РАН. – 2006. – Т. 2, № 2. – С. 83–92.
Некрасова М. Я. Зообентос Азовского моря после зарегулирования стока Дона // Зоологический журнал. – 1972. – Т. 51, Вып. 6. – С. 789–797.
Некрасова М. Я. Изменения бентоса Азовского моря под влиянием осолонения // Зоологический журнал. – 1977. – Т. 56, Вып. 7. – С. 983–989.
Ревков Н. К., Щербань С. А. Особенности биологии двустворчатого моллюска Anadara kagoshimensis в Черном море // Экосистемы. – 2017. – Вып. 9 (39). – С. 47–56.
Савчук М. Я. Mya arenaria L. – новый элемент в фауне Азовского моря // Вестник зоологии. – 1980. – № 5. – С. 11–15.
Спичак М. К. Гидрологический режим Азовского моря в 1951–57 гг. и его влияние на некоторые химические и биологические процессы // Труды АзНИИРХ. – 1960. – Т. 1, Вып. 1. – С. 115–142.
Старк И. Н. Состояние кормовой базы бентосоядных рыб северо-восточной части Азовского моря // Труды АзЧерНИРО. Сборник работ по Азовскому морю. – Крымиздат: Симферополь, 1951. – Вып. 15. – С. 201–233.
Старк И. Н. Годовая и сезонная динамика бентоса в Азовском море // Труды АзНИИРХ. – 1960. – Т. 1, Вып. 1. – С. 167–229.
Студеникина Е. И., Воловик С. П., Толоконникова Л. И., Фроленко Л. Н., Селиванова Е. В. Характеристика донных сообществ Азовского моря в современный период // Основные проблемы рыбного хозяйства и охраны рыбохозяйственных водоемов Азово-Черноморского бассейна (Cборник научных трудов (1996–1997 гг.)). – Ростов-на-Дону: Изд-во АзНИИРХ, 1998. – С. 67–77.
Терентьев А. С. Макрозообентос юго-западной части Азовского моря в условиях эксплуатации газоконденсатных месторождений // Екологічна безпека прибережної та шельфової зон та комплексне використання ресурсів шельфу (Збірник наукових праць). – Севастополь, 2008. – Вип. 17. – С. 327–348.
Фроленко Л. Н. Зообентос Азовского моря в условиях антропогенных воздействий: автореф. дис. … канд. биол. наук: спец. 03.00.16. – Краснодар, 2000. – 24 с.
Фроленко Л. Н. Оценка состояния донных биоценозов Азовского моря // Основные проблемы рыбного хозяйства и охраны рыбохозяйственных водоемов Азово-Черноморского бассейна (Cборник научных трудов (2004–2005 гг.)). – Ростов н/Д: Изд-во АзНИИРХ, 2006. – С. 77–87.
Фроленко Л. Н., Двинянинова О. В. Формирование биоценоза вселенца кунеарки Cunearca cornea в Азовском море // Основные проблемы рыбного хозяйства и охраны рыбохозяйственных водоемов Азово-Черноморского бассейна. – Ростов-на-Дону: Изд-во АзНИИРХ, 1998. – С. 115–118.
Фроленко Л. Н., Мальцева О. С. О сообществе Anadara в Азовском море // Современные рыбохозяйственные и экологические проблемы Азово-Черноморского региона: Матер. IX междунар. науч.-практ. конф. (Керчь, 6 октября 2017 г.). – Керчь: КФ (ЮгНИРО) ФГБНУ АзНИИРХ, 2017. – С. 99–103.
Фроленко Л. Н., Семиглазова А. В. Трансформация биоценоза церастодермы Cerastoderma lamarcki в условиях антропогенного преобразования режима Азовского моря // Основные проблемы рыбного хозяйства и охраны рыбохозяйственных водоемов Азово-Черноморского бассейна. – Ростов-на-Дону: Изд-во АзНИИРХ, 1998. – С. 118–122.
Чихачев A. C., Фроленко Л. Н., Реков Ю. И. Новый вселенец в Азовское море // Рыбное хозяйство. – 1994. – № 3. – С. 40–41.
Clarke K. R. Non-parametric multivariate analyses of changes in community structure // Australian Journal of Ecology. – 1993. – Vol. 18. – P. 117–143.
Clarke K. R., Gorley R. M. PRIMER v5: User Manual/Tutorial. Primer–E. – Plymouth, 2001. – 92 p.
Radashevsky V. I., Selifonova Zh. P. Records of Polydora cornuta and Streblospio gynobranchiata (Annelida, Spionidae) from the Black Sea // Mediterranean Marine Science. – 2013. – Vol. 14, N 2. – P. 261–269.
Syomin V., Stradomsky B., Fomina E., Matishov D., Sikorski A., Bastrop R., Köhler N. The invasion of the genus Marenzelleria (Polychaeta: Spionidae) into the Don river mouth and the Taganrog bay: morphological and genetic study // Journal of the Marine Biological Association of the UK. – 2017. – Vol. 97, N 5. – P. 975–984.