Актуальность
Основной причиной, по которой больные после радикального лечения рака молочной железы (РМЖ) обращаются к специалистам по медицинской реабилитации, является отек верхней конечности на стороне операции [1, 2]. В его возникновении и развитии имеют значение не только лимфатические, но и венозные нарушения [1–3]. Уменьшение венозного оттока, появление не лимфатического, а лимфовенозного отека (флеболимфедемы) в подавляющем большинстве случаев вызвано экстравазальными стенозами подмышечной и/или подключичной вены фиброзированными тканями, образовавшимся лимфоцеле, но могут встречаться и интравазальные нарушения — тромбоз подключично-подмышечного сегмента (рисунок) или посттромбофлебитический синдром после ранее перенесенного флеботромбоза [2, 3].
Рисунок. Подключично-подмышечный венозный тромбоз
Частота тромботических событий у больных РМЖ с постмастэктомическим отеком верхней конечности невелика — по данным различных авторов, она составляет 0,23–0,8–4,7% [1, 6–8].
Диагноз и анализ результатов лечения флеботромбоза общепринято проводить на основании данных клинического осмотра, волюметрии, ультразвукового исследования вен [10] и оценке биомаркеров гомоцистеина, D-димера и продуктов разложения фибрина [8, 9]. Для оценки тромботического состояния гомеостаза также исследуют гемореологический статус, нарушение которого во многом определяет свойства кровотока [11]. Его основными характеристиками являются такие параметры, как вязкость крови и плазмы, гематокрит, агрегация эритроцитов и их деформационные свойства, позволяющие им проходить через сосуды, диаметр которых меньше диаметра самих эритроцитов [12].
Коррекция гемореологических нарушений представляет определенные трудности, и для предотвращения тромботического процесса, нормализации кровообращения предложены различные методы, в том числе физиотерапевтические процедуры [13–15].
Цель — исследовать влияние некоторых физических факторов на реологический статус больных раком молочной железы с флеботромбозом подмышечной вены на стороне радикальной мастэктомии.
Материалы и методы
Объектом исследования были 98 больных (45–70 лет, средний возраст 53,8) раком молочной железы I–IIIА стадии и три клинические группы диспансерного наблюдения. Радикальное противоопухолевое лечение включало радикальную мастэктомию по Маддену у 100% больных, из них у 42 (42,9%) она сочеталась с адъювантной дистанционной лучевой терапией и у 48 (49%) — с полихимиотерапией. Давность проведенного лечения составляла 8–24 месяца, а существования постмастэктомического отека — 13,6 ± 2,9 месяца.
При амбулаторном обращении больные предъявляли жалобы на появление за последние 2–3 недели умеренных распирающих болей и увеличение отека верхней конечности на стороне операции. При осмотре: постоянный, не исчезающий после отдыха отек верхней конечности, равномерный цианотичный цвет кожи верхней конечности ниже подмышечной впадины, при опускании конечности цианоз усиливался, при подъеме — уменьшался. Рисунок поверхностных вен конечности контурирован, кожу нельзя было взять в складку, и она не смещалась по отношению к подлежащим тканям, конечность при пальпации болезненная с незначительным повышением местной, но не общей температуры, питтинг-тест положительный, после него на месте надавливания появлялся участок светлой кожи, который быстро становится вновь цианотичным. Функция конечности не была нарушена. Пульсация на периферических артериях верхних конечностей сохранена, симметричная. При погружении отечной конечности в градуированную емкость с водой (волюметрия) было отмечено превышение ее объема по сравнению с контралатеральной конечностью на 500–700 см3, в среднем составляя 3281,6 ± 112,2 против 2640 ± 117,1 см3 (превышение на 641,6 см3, или на 24,3%). На основании клинической картины и объемных измерений был установлен диагноз: поздний лимфовенозный отек верхней конечности II степени; подострый тромбоз подмышечной вены на стороне операции.
Диагноз был инструментально верифицирован при ультразвуковом ангиосканировании. Для этого проводилось ультразвуковое исследование с высоким разрешением в В-режиме и триплексном доплеровском режиме, в том числе цветовое доплеровское и энергетическое картирование на аппарате MyLab (Esaote, Италия). Был установлен вид тромбоза — окклюзивный тромбоз (неэмболоопасная форма): беспорядочные отражения в просвете подмышечной вены определялись как пристеночно, так и центрально, в доплеровском или цветовом режиме сигналы в просвете вены не регистрировались, при компрессионной пробе — ригидность венозной стенки, расширение просвета вены, контур венозной стенки ровный.
После установления диагноза был использован комплекс общепринятых методов оценки реологических свойств крови: вискозиметрия производилась на ротационном вискозиметре Rotoviscо 100 (Haake, Германия) в диапазоне скоростей сдвига от 1 до 150 с—1, что соответствовало условиям венозного и артериального кровотока; агрегацию эритроцитов определяли на нефелометре-колориметре ФЭК-56М (Россия); показатель гематокрита измеряли на гематокритной центрифуге (Аутокрит, США), АДФ-индуцированную агрегацию тромбоцитов (концентрация АДФ — 2 мкмоль/л) оценивали с помощью тромбоцитарного агрегометра Elvi-840 (Италия). В качестве референсных значений для изучаемых параметров гемореологии использовали результаты исследования 34 практически здоровых женщин.
Исследования проводили в двух временных точках — после установки диагноза флеботромбоза и на 7-й день от начала реабилитационных мероприятий.
Всем больным с постмастэктомическим тромбозом подмышечной вены была назначена базисная пероральная антикоагулянтная терапия эноксапарином [10]. Больные методом простой рандомизации были разделены на три сопоставимые группы.
Неинвазивные, не требующие нарушения целостности кожного покрова отечной конечности методы физиотерапии дополнительно получили две группы больных, давших согласие на включение в исследование, а именно локальное экстракорпоральное/чрескожное низкочастотное низкоинтенсивное воздействие на место тромбоза: 40 больных 1 группы — магнитотерапию и 37 больных 2 группы — лазеротерапию. Контрольная 3 группа с пероральной антикоагулянтной терапией состояла из 21 больной.
При использовании переменного магнитного поля прямоугольные индукторы располагали контактно у внутренней поверхности плеча с упором в подмышечную область разноименными полюсами друг к другу. Назначали синусоидальное магнитное поле частотой 50 Гц, в непрерывном режиме, магнитную индукцию 40 мТл, экспозиция 20 мин. Процедуры проводили в течение 10–12 дней ежедневно.
Инфракрасное непрерывное лазерное излучение проводили контактно без компрессии на подмышечную область по стабильной методике при плотности потока мощности 20–50 мВт/см2, время воздействия — 15–20 мин, ежедневно в течение 10–12 дней.
Обработку данных проводили с использованием программы MS Excel и пакета прикладных программ Statistica 12.6 для Windows.
Результаты и их обсуждение
Полученные исходные параметры реологических свойств крови свидетельствуют о значительных изменениях гемореологического профиля наблюдаемых больных РМЖ (таблица). Так, структурная и динамическая вязкость крови в 2,8 и в 1,6 раза соответственно, агрегация эритроцитов — в 1,5 раза и агрегация тромбоцитов — в 1,4 раза превышают референсные показатели. Величина гематокрита на 8 % ниже нормы. Подобная степень гемореологических изменений свидетельствует о значительных нарушениях физических и биохимических характеристик крови, сопровождающих тромботический процесс в подострой фазе. Следует отметить, что полученные результаты подтверждаются данными литературы, свидетельствующими о том, что гемореологические расстройства являются неспецифической реакцией организма на любые изменения в системе гомеостаза и которые по мере прогрессирования заболевания становятся одним из звеньев патогенеза нарушений микро- и макрогемодинамики [16].
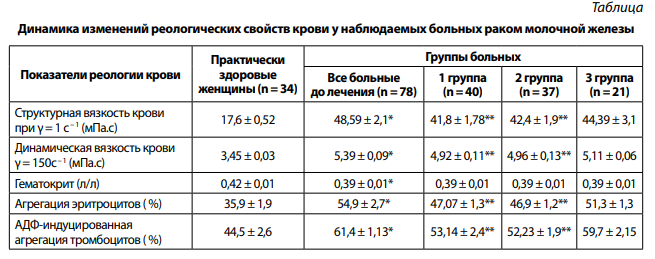
Примечание: *р < 0,05 — различия, статистически значимые при сравнении гемореологических показателей у практически здоровых женщин и у больных РМЖ до лечения; **р < 0,05 — различия статистически значимые при сравнении гемореологических показателей в группах больных до и после лечения.
Как видно из таблицы, изменения гемореологических параметров свидетельствуют о том, что медикаментозная монотерапия (3 группа) не вызвала статистически значимых изменений в изучаемых показателях. В 1 и 2 группах больных, которым проводилась физиотерапия, было выявлено статистически значимое снижение структурной и динамической вязкости крови в среднем на 15,5 и на 16,5 % соответственно, агрегации эритроцитов — на 14,5 % и тромбоцитов — на 14,5% по сравнению с показателями до лечения. Величина гематокрита у всех больных не изменилась по сравнению с исходной (до лечения). Сравнительный анализ степени изменения гемореологических параметров у больных 1 и 2 групп не выявил статистически значимых различий между ними. Данное впервые выявленное обстоятельство свидетельствует об однонаправленности физического воздействия магнитотерапии и лазеротерапии в сочетании с базисным медикаментозным лечением на реологические свойства крови.
Однако, опираясь на данные литературы, точки воздействия магнитного поля и лазерного излучения на реологию крови различаются.
Магнитное поле, влияя на движущиеся в кровотоке электрически заряженные эритроциты и тромбоциты, изменяет физико-химические и биохимические процессы, происходящие в мембранах этих клеток и, по сути, является триггерным механизмом, ведущим к изменению их функционального состояния [17]. Иными словами, эффект магнитотерапии реализуется через воздействие на электрические свойства мембран эритроцитов и тромбоцитов, вследствие чего повышается их электрофоретическая подвижность, происходит электростатическое отталкивание форменных элементов друг от друга и они дезагрегируют. При этом увеличивается суспензионная стабильность крови, снижается ее вязкость и возрастает скорость кровотока и венозного оттока.
Наиболее популярной теорией, согласно которой реализуется терапевтический эффект инфракрасного лазерного излучения, является его поглощение биомолекулами, клетками и тканями, в результате чего осуществляется фотобиологическая реакция организма. Основополагающая роль в этой реакции принадлежит порфирин-содержащим клеткам — эритроцитам. Инфракрасные лучи также воздействуют на мембраны эритроцитов, но на их сократительные белки, приводя к конформационному изменению эритроцитарной мембраны. Деформационные свойства эритроцитов возрастают, клетки становятся более пластичными, укладываются в монетные столбики оптимального размера, что выражается в снижении их агрегационной активности и вязкости крови, улучшается структура кровотока. При этом эритроциты меньше выделяют биологически активных веществ, стимулирующих агрегацию тромбоцитов. Помимо эритроцитов, в качестве акцепторов лазерного излучения выступают белки и липиды плазмы крови. Лазеротерапия вызывает конформационные изменения их мембран, снижая их воздействие на агрегационные свойства форменных элементов крови и улучшая реологию в целом [18].
Как показало проведенное нами исследование, положительный эффект лазеротерапии и магнитотерапии был подтвержден клиническими проявлениями. В частности, через 6 дней сочетанной терапии у больных был купирован болевой синдром, цвет кожи отечной конечности становился менее цианотичным, исчезло чувство распирания/тяжести в отечной верхней конечности. После окончания курса лечения уменьшение лимфовенозного отека верхней конечности у больных 1 группы в среднем составило 16,5 ± 1,2%, у больных 2 группы — 13,8 ± 1,8%, у больных 3 группы — 7,5 ± 1,4%. Реканализация просвета подмышечной вены отмечалась у больных 1 группы до 80%, 2 группы — до 70% и 3 группы — около 30%.
Выводы
Оценивая эффективность магнитотерапии и лазеротерапии на тромботический процесс в подострой фазе у больных РМЖ через улучшение гемореологического профиля, можно утверждать, что оба метода лечения минимизируют у них клинические проявления и улучшают реологию крови. Реологический статус больных может быть потенциальным маркером эффективности их реабилитации. Тот факт, что гемореологические показатели у больных РМЖ не достигли своей физиологической нормы, объясняется спецификой самого тромботического процесса: многофакторность этиопатогенеза венозного тромбоза, инертный характер гемореологических нарушений — всё это значительно затрудняет терапию данного заболевания и диктует необходимость поиска новых немедикаментозных (физиотерапевтических) способов коррекции гемореологических нарушений.
Конфликт интересов
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи, о которых следует сообщить.
Информация о финансировании
Работа выполнена только за счет личных средств автора.
Вклад авторов
Жаворонкова В. В. — сбор и предварительная обработка материалов, составление черновика рукописи.
Грушина Т. И. — концепция и дизайн исследования, редактирование статьи.
Александрова Н. П. — анализ и оценка полученных данных.
Conflict of interest
The authors declare no conflict of interest related to the publication of this article. The authors received no specific funding for this work.
Funding
The authors received no specific funding for this work.
Author contributions
Zhavoronkova V.V. — сollection and pre-processing of materials; drafting of the manuscript.
Grushina T.I. — сoncept and design of the study; editing the article.
Aleksandrova N.P. — аnalysis and evaluation of the obtained data.


