Перейти к:
Биомаркеры воспаления и эндотелиальной дисфункции у пожилых пациентов с инфарктом миокарда, артериальной гипертензией и синдромом старческой астении
https://doi.org/10.15829/1728-8800-2023-3364
Аннотация
Цель. Анализ уровня биомаркеров воспаления и эндотелиальной дисфункции у пожилых пациентов с инфарктом миокарда (ИМ), артериальной гипертензией (АГ) и синдромом старческой астении (ССА).
Материал и методы. Сформировано три клинические группы: пациенты 60-74 лет с ИМ+АГ 1-2 ст. (n=80); пациенты 60-74 лет с ИМ+АГ+преастения (ПА) (n=52); пациенты 60-74 лет с ИМ+АГ+ССА (n=114). У пациентов всех групп через 2-4 мес. после ИМ определялись уровни высокочувствительного С-реактивного белка (вчСРБ), молекул межклеточной адгезии (ICAM-1), метаболитов оксида азота (NO) — нитратов и нитритов, эндотелина-1, десквамированных эндотелиоцитов, фактора роста роста эндотелия сосудов (VEGF).
Результаты. У пациентов с ИМ+АГ+ССА установлено более высокое содержание в крови вчСРБ — 6,4 мг/л по сравнению с пациентами с ИМ+АГ+ПА (4,2 мг/л; p<0,01) и с пациентами с ИМ+АГ (3,2 мг/л; p<0,01). Уровень другого биомаркера воспаления ICAM-1 составил в указанных группах 315,6, 242,7 и 213,5 нг/мл, соответственно (р<0,01). У пациентов с ИМ+АГ+ПА диагностированы низкие уровни нитрита (NO2-) и нитрата (NO3-) — 6,7 и 5,4 мкмоль/л у пациентов с ИМ+АГ+ССА vs 7,2 мкмоль/л у пациентов с ИМ+АГ (p<0,01). Аналогичное соотношение присуще нитрату NO3-. Напротив, содержание десквамированных эндотелиоцитов и VEGF было статистически значимо выше у пациентов с ИМ+АГ+ССА по сравнению с пациентами с ИМ+АГ+ПА (р<0,01). Существенно выше у пациентов с ИМ+АГ+ССА по сравнению с группой ИМ+АГ+ПА оказался и уровень эндотелина-1: 18,85 vs 13,41 фмоль/л в (p<0,05). Заключение. Уровни показателей воспаления и эндотелиальной дисфункции у пациентов с ИМ+АГ статистически значимо превышают таковые у пациентов с ИМ+АГ+ССА по сравнению с пациентами с ИМ+АГ+ПА и с ИМ+АГ, за исключением метаболитов оксида азота.
Ключевые слова
Для цитирования:
Агарков Н.М., Охотников О.И., Голиков А.В., Колпина Л.В., Коломиец В.И. Биомаркеры воспаления и эндотелиальной дисфункции у пожилых пациентов с инфарктом миокарда, артериальной гипертензией и синдромом старческой астении. Кардиоваскулярная терапия и профилактика. 2023;22(3):3364. https://doi.org/10.15829/1728-8800-2023-3364
For citation:
Agarkov N.M., Okhotnikov O.I., Golikov A.V., Kolpina L.V., Kolomiets V.I. Biomarkers of inflammation and endothelial dysfunction in elderly patients with myocardial infarction, hypertension and frailty. Cardiovascular Therapy and Prevention. 2023;22(3):3364. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3364
Введение
Ведущим фактором риска инфаркта миокарда (ИМ) в пожилом возрасте выступает артериальная гипертензия (АГ), диагностируемая в 82-87% случаев соответственно при типичном и атипичном развитии ИМ [1]. За последние десять лет значительно увеличилось число пациентов старших возрастных групп с ИМ+АГ и другими сопутствующими заболеваниями [2], оказывающими существенное негативное влияние на гериатрический статус пациентов с данной сердечно-сосудистой патологией [3, 4]. Около трети пациентов, госпитализированных с острым коронарным синдромом, составляют лица старческого возраста [5], среди которых широко распространен основной гериатрический синдром — синдром старческой астении (ССА), считающийся неблагоприятным вариантом старения, и оказывающий влияние на течение и исходы ИМ [6].
Однако сведения о ССА среди пациентов с ИМ+АГ ограничены. Неизвестными остаются маркеры воспаления и эндотелиальной дисфункции (ЭД) у пациентов пожилого возраста с ИМ+АГ+ССА, поскольку в предыдущих исследованиях эти показатели рассматривались раздельно среди пациентов с ИМ, при ССА и АГ. В частности, анализируется содержание С-реактивного белка (СРБ) у пожилых с ССА [7], высокочувствительного СРБ (вчСРБ) в оценке ССА и для прогнозирования смерти от всех причин и от сердечно-сосудистых заболеваний [8], молекул межклеточной адгезии (ICAM-1 Intercellular adhesion molecule-1) с распространенностью ССА среди пожилых тайванцев [9], связь показателей ЭД и ССА [10]. Раздельно представлены в современных публикациях [11-13] сведения о биомаркерах воспаления, ЭД у пациентов только с ИМ [14], т.е. без АГ и ССА, что не позволяет оценить влияние сочетания ИМ+АГ+ССА на нарушения в системе воспаления и эндотелия, необходимые для понимания общепатологических процессов при вышеназванных заболеваниях и для использования их при ведении и прогнозировании исходов ИМ и определения вклада ССА в изменение обсуждаемых биомаркеров.
Цель исследования — анализ уровня биомаркеров воспаления и ЭД у пожилых пациентов с ИМ+АГ+ССА.
Материал и методы
Настоящее исследование представляет одномоментное исследование, выполненное в 2020-2021гг на базе городской клинической больницы № 1 г. Курска. В исследование включались пациенты через 2-4 мес. после перенесенного ИМ+АГ, проходившие диспансерное наблюдение в вышеназванном лечебно-профилактическом учреждении, у которых в этот период (2-4 мес. после ИМ) проводился забор крови для изучения содержания показателей воспаления и ЭД. На этом же этапе у пациентов с ИМ+АГ проводилось выявление ССА и дифференциация данного гериатрического синдрома на ССА и преастению (ПА).
При выполнении исследования было сформировано три клинические группы: пациенты 60-74 лет с ИМ+АГ 1-2 ст. (n=80, средний возраст 68,4±3,1 года); пациенты 60-74 лет с ИМ+АГ 1-2-й ст.+ПА (n=52, средний возраст 68,1±2,9 лет); пациенты 60-74 лет с ИМ+АГ 1-2-й ст.+ССА (n=114, средний возраст 69,4±3,5 лет).
В исследование не включались пациенты, не достигшие 60 лет и старше 74 лет, с АГ 3 ст., хронической сердечной недостаточностью III-IV функционального класса, осложненными формами ИМ (отек легких, кардиогенный шок), онкологической патологией, индексом массы тела >30 кг/м2, острыми и хроническими заболеваниями печени и почек, с печеночной и почечной недостаточностью, заболеваниями щитовидной железы, перенесенным нарушением мозгового кровообращения, сахарным диабетом 1-го и 2-го типов, острой инфекционной патологией; пациенты, принимающие нестероидные противовоспалительные средства; пациенты с сопутствующими заболеваниями, влияющими на уровень воспаления. За 3-4 сут. до забора крови у пациентов исключался прием статинов по согласованию с медицинской организацией, руководством больницы, что отражено в подписанном пациентами информированном согласии. Диагноз ИМ без подъема сегмента ST устанавливался на основании медицинской документации (выписка из медицинской карты амбулаторного больного). Коронарная ангиография пациентам не проводилась.
АГ выявлялась в соответствии с "Национальными рекомендациями Всероссийского научного общества кардиологов 4-го пересмотра по диагностике и лечению АГ" [15].
Фенотип ССА определяли по критериям Fried LP [16]. ПА определяли при наличии двух положительных ответов на вопросы шкалы Fried LP, а наличие трех положительных ответов соответствовало ССА. При отсутствии положительных ответов пациента относили к группе с отсутствием ССА. Для верификации ПА и ССА выполнялась динамометрия аппаратом "ДМЭР-120". Исследование силы кисти выполнялось в соответствии с требованиями Гронингемского теста оценки уровня физической активности. Скорость ходьбы определялась по тесту "Скорость ходьбы на 4 м", а уровень низкой физической активности при наличии ≤38 баллов по тесту "Опросник двигательной активности ODA23+".
Среди маркеров воспаления изучались вчСРБ, уровень которого определялся на биохимическом анализаторе BS-300 методом иммунотурбидиметрии, и ICAM-1, концентрацию которого определяли иммуноферментным методом с использованием наборов "Biomedica". Забор крови осуществлялся во всех случаях в утренние часы натощак. Для определения концентрации всех биомаркеров воспаления и ЭД использовалась негемолизированная сыворотка крови, буферный раствор с полиэтиленгликолем и антисыворотка с моноспецифическими антителами. Полученную сыворотку аликвотировали и замораживали при -700 С до выполнения анализа.
Среди параметров ЭД определялись нитриты (NO2-), нитраты (NO3-), их сумма, эндотелин-1, десквамированные эндотелиоциты, VEGF.
Содержание в сыворотке крови NO2- и NO3- определяли на спектрофотометре СФ-46 при длине волны 540 нм по методике Грисса. Эндотелин-1, десквамированные эндотелиоциты, VEGF определяли иммуноферментным анализом с набором "Biomedica". Перед определением содержания NO2- и NO3- сыворотку крови депротеинизировали этиловым спиртом 960 в соотношении 1:2 и замораживали при -200 С. Десквамированные эндотелиоциты, эндотелин-1, фактор роста эндотелия сосудов (VEGF) определяли в замороженной при -200 С плазме.
Показатели липидограммы и уровень глюкозы изучали посредством автоанализатора "Konelab-300".
Обобщённая характеристика обследованных групп представлена в таблице 1; согласно приведенным данным, среди пациентов рассматриваемых трех групп не установлено статистически значимых различий по содержанию в крови триглицеридов, холестерина липопротеинов низкой плотности, холестерина липопротеинов высокой плотности. Сравниваемые группы пациентов статистически значимо не различались по наличию сопутствующих заболеваний (p>0,05).
Исследование проводилось в соответствии с Хельсинкской декларацией и стандартами надлежащей клинической практики (Good Clinical Practice). Исследование одобрено этическим комитетом Юго-Западного государственного университета, а пациенты включались в него после подписания информированного согласия.
Полученные данные заносились в специально созданные электронные таблицы Microsoft Office Excel и подвергались статистической обработке с применением стандартного пакета "Statistica 10.0". При обработке результатов лабораторных и инструментальных исследований производился расчет медианы (Ме) с интерквартильным размахом (Q25; Q75), а также применялся метод многомерного статистического анализа — иерархический кластерный анализ.
Достоверность полученных результатов оценивалась по критерию Краскела-Уоллиса с поправкой Бонферрони и различие принималось статистически значимым при р<0,05.
Результаты
Изучение показателей воспаления через 2-4 мес. после ИМ в трех клинических группах предусматривало определение содержания вчСРБ и IСАМ-1 (таблица 2). Содержание в крови этих маркеров было статически значимо выше у больных пожилого возраста с ИМ+АГ+ПА по сравнению с пациентами группы ИМ+АГ. У пациентов с ИМ+АГ+ССА уровень маркеров воспаления также оказался выше не только по сравнению с пациентами ИМ+АГ, но и с пациентами с ИМ+АГ+ПА. Эти результаты свидетельствуют о наличии ассоциации между их повышенным уровнем и ИМ+АГ+ССА.
Среди параметров эндотелиальной дисфункции у пожилых больных ИМ+АГ+ПА, ИМ+АГ+ССА статически значимо снижено содержание NO2-, чем у пациентов с ИМ+АГ. Однако концентрация NO3- достоверно ниже только у пациентов с ИМ+АГ+ССА по сравнению с двумя другими группами.
Наряду с этим у пациентов пожилого возраста с ИМ+АГ+ПА уровни эндотелина-1, десквамированных эндотелиоцитов и VEGF (p<0,01) статистически значимо выше по сравнению с пациентами с ИМ+АГ. Наибольшее содержание среди названных выше параметров присуще эндотелину-1, концентрация которого оказалась выше в 2,6 раза у пациентов с ИМ+АГ+ССА и, наоборот, минимальное — VEGF. Дестабилизация других патологических процессов в эндотелии повысилась также у пациентов 60-74 лет с ИМ+АГ+ССА. В частности, все исследуемые параметры ЭД у пациентов пожилого возраста с ИМ+АГ+ССА существенно увеличились по сравнению с предыдущей группой — ИМ+АГ+ПА. У пациентов с ИМ+АГ+ССА в пожилом возрасте содержание в крови метаболитов NO имело наименьшие значения по сравнению с двумя другими клиническими когортами (p<0,01) (таблица 3).
Репрезентативно низкой в периферической крови больных ИМ+АГ+ССА оказалась концентрация суммарных метаболитов NO — NO2- и NO3- по сравнению с пациентами с ИМ+АГ+ПА (p<0,01). Напротив, уровни эндотелина-1, десквамированных эндотелиоцитов и VEGF у пациентов с ИМ+АГ+ССА достоверно выше (p<0,01), чем в двух других клинических группах.
Таким образом, через 2-4 мес. у пожилых пациентов с ИМ+АГ+ПА и ИМ+АГ+ССА параметры ЭД значимо отличались от таковых у пациентов с ИМ+АГ. При этом содержание суммарных NO2- и NO3- оказалось ниже (p<0,01), а уровень эндотелина-1, VEGF и десквамированных эндотелиоцитов — достоверно выше (p<0,01) у пациентов с ИМ+АГ+ССА, чем у пациентов с ИМ+АГ.
Оценка взаимодействия вазодилатирующих и вазопрессорных маркеров ЭД у больных ИМ+ АГ+ПА пожилого возраста с применением кластерного метода показывает интеграцию эндотелина-1 и десквамированных эндотелиоцитов, образующих 1-й кластер (рисунок 1).
С эндотелином-1, десквамированными эндотелиоцитами взаимодействует VEGF. Следует отметить, что интеграция вазопрессорных субстратов у пожилых больных ИМ+АГ+ПА более высокая, чем NO2- и NO3-. Они взаимодействуют между собой на более низком уровне интеграции. Между NO2- и NO3- и эндотелином, десквамированными эндотелиоцитами и VEGF выявлена опосредованная интеграция через 2-й кластер и 4-й кластер.
Анализ взаимодействия между показателями ЭД у больных пожилого возраста с ИМ+АГ+ССА свидетельствует о более высоком уровне интеграции биомаркеров ЭД у этих больных по сравнению с пациентами с ИМ+АГ+ПА (рисунок 2). Особенно это относится к взаимодействию эндотелина-1 и VEGF. Незначительно повысилась степень интеграции между содержанием NO2 и NO3 в крови.
Эти результаты подчеркивают повышение сопряженности параметров ЭД у пациентов с ИМ+АГ+ССА по сравнению с пациентами аналогичного возраста с ИМ+АГ+ПА. Ведущими биомаркерами воспаления и ЭД у пожилых пациентов с ИМ+АГ+ССА следует считать эндотелин-1 и десквамированные эндотелиоциты, образующие 1-й кластер при наивысшей интеграции.
Таблица 1
Общая характеристика обследованных групп пациентов
Исследуемый показатель | Пациенты 60-74 лет | Пациенты 60-74 лет с ИМ+АГ+ПА, n=52 | Пациенты 60-74 лет с ИМ+АГ+ССА, n=114 |
Средний возраст, лет | 68,4±3,1 | 68,1±2,9 | 69,4±3,5 |
Количество пациентов, n | 80 | 52 | 114 |
Мужчины, n | 38 | 24 | 54 |
Женщины, n | 42 | 28 | 60 |
Продолжительность АГ, лет | 6,8±1,4 | 12,5±2,2 | 12,8±2,4* |
Передняя локализация ИМ, n | 48 | 36 | 71 |
Задняя локализация ИМ, n | 32 | 16 | 43 |
Триглицериды, ммоль/л, Мe [Q1-Q3] | 2,1 [ 2,0-2,3] | 2,0 [ 1,8-2,2] | 2,2 [ 2,1-2,3] |
ХС ЛНП, ммоль/л, Мe [Q1-Q3] | 4,0 [ 3,9-4,1] | 4,1 [ 3,9-4,2] | 4,0 [ 3,8-4,2] |
ХС ЛВП, ммоль/л, Мe [Q1-Q3] | 1,1 [ 1,0-1,3] | 1,0 [ 0,9-1,1] | 1,1 [ 1,0-1,3] |
Глюкоза, ммоль/л, Мe [Q1-Q3] | 5,5 [ 5,3-5,6] | 5,2 [ 5,0-5,5] | 5,1 [ 4,9-5,2]** |
ХСН I-II ФК, n | 32 | 24 | 51 |
Нарушение ритма, n | 6 | 4 | 9 |
Перенесенный ранее ИМ, n | 8 | 6 | 16 |
Стенокардия, n | 30 | 21 | 46 |
Примечание: * — p<0,01 между группами с ИМ+АГ+ПА и ИМ+АГ+ССА, ** — p<0,01 между пациентами с ИМ+АГ и ИМ+АГ+ССА. АГ — артериальная гипертензия, ИМ — инфаркт миокарда, ПА — преастения, ССА — синдром старческой астении, ХС ЛНП — холестерин липопротеинов низкой плотности, ХС ЛВП — холестерин липопротеинов высокой плотности, ХСН — хроническая сердечная недостаточность, ФК — функциональный класс.
Таблица 2
Маркеры воспаления у больных пожилого возраста с ИМ+АГ, с ИМ+АГ+ПА, с ИМ+АГ+ССА (Мe [Q1-Q3])
Исследуемый показатель, | Пациенты пожилого возраста с ИМ+АГ, n=80 | Пациенты 60-74 лет с ИМ+АГ+ПА, n=52 | Пациенты 60-74 лет с ИМ+АГ+ССА, n=114 |
вчСРБ, мг/л | 3,2 [ 3,1-3,4] | 4,2 [ 3,9-4,5]* | 6,4 [ 6,2-6,6]** |
IСАМ-1, нг/мл | 213,5 [ 211,2-218,9] | 242,7 [ 239,1-247,7]* | 315,6 [ 311,4-318,7]** |
Примечание: * — p<0,01 между пациентами с ИМ+АГ и ИМ+АГ+ПА, ** — p<0,01 между пациентами с ИМ+АГ+ПА и ИМ+АГ+ССА. АГ — артериальная гипертензия, вчСРБ — высокочувствительный С-реактивный белок, ИМ — инфаркт миокарда, ПА — преастения, ССА — синдром старческой астении, ICAM-1 — Intercellular adhesion molecule-1 (молекула межклеточной адгезии-1).
Таблица 3
Параметры ЭД у больных ИМ+АГ, ИМ+АГ+ПА, ИМ+АГ+ССА в пожилом возрасте (Мe [Q1-Q3])
Исследуемый показатель, | Пациенты пожилого возраста с ИМ+АГ, n=80 | Пациенты пожилого возраста с ИМ+АГ+ПА, n=52 | Пациенты пожилого возраста с ИМ+АГ+ССА, n=114 |
NO2-, мкмоль/л | 7,2 [ 7,0-7,4] | 6,7 [ 6,4-6,9]* | 5,4 [ 5,2-5,5]** |
NO3-, мкмоль/л | 12,2 [ 12,0-12,6] | 11,5 [ 11,2-11,8] | 8,7 [ 8,4-9,0]** |
Сумма NO2- и NO3-, мкмоль/л | 20,4 [ 19,2-21,8] | 19,3 [ 18,2-20,9] | 13,4 [ 12,5-15,6]** |
Эндотелин-1, фмоль/л | 7,23 [ 6,84-7,91] | 13,41 [ 11,86-12,32]* | 18,85 [ 17,08-22,15]** |
Десквамированные эндотелиоциты, | 3,0 [ 2,8-3,5] | 4,6 [ 4,3-4,8]* | 8,2 [ 7,9-9,3]** |
VEGF, пг/мл | 534,2 [ 539,7-546,3] | 552,9 [ 548,5-560,4]* | 574,8 [ 571,3-586,8]** |
Примечание: * — p<0,05 между пациентами с ИМ+АГ и ИМ+АГ+ПА, ** — p<0,05 между пациентами с ИМ+АГ+ПА и ИМ+АГ+ССА. АГ — артериальная гипертензия, ИМ — инфаркт миокарда, ПА — преастения, ССА — синдром старческой астении, NO2- — нитрит, NO3- — нитрат, VEGF — vascular endothelial growth factor (фактор роста эндотелия сосудов).
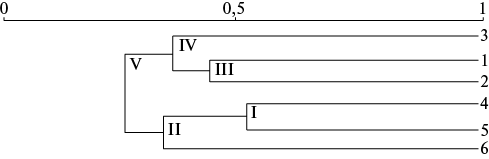
Рис. 1 Взаимодействие показателей ЭД через 2-4 мес. после ИМ у больных пожилого возраста с ИМ+АГ+ПА.
Примечание: 1 — содержание в крови NO2-, 2 — содержание в крови NO3-, 3 — сумма NO2- и NO3-, 4 — содержание в крови эндотелина-1, 5 — содержание в крови десквамированных эндотелиоцитов, 6 — содержание в крови VEGF, I-V — номера кластеров.
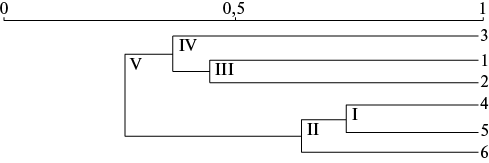
Рис. 2 Взаимодействие показателей ЭД у больных пожилого возраста с ИМ+АГ+ССА.
Примечание: 1 — содержание в крови NO2, 2 — содержание в крови NO3, 3 — сумма NO2 и NO3, 4 — содержание в крови эндотелина-1, 5 — содержание в крови десквамированных эндотелиоцитов, 6 — содержание в крови VEGF, I-V — номера кластеров.
Обсуждение
У пациентов с ИМ+АГ+ССА по сравнению с двумя другими группами выявлены более высокие (p<0,01) уровни биомаркеров воспаления и ЭД. Согласно результатам ранее выполненного исследования [13] у пациентов более молодого возраста с изолированным ИМ (без АГ и ССА) содержание ICAM-1 в сыворотке на 12-14 сут. после развития ИМ составляло 44,9 пг/мл, что статистически значимо ниже полученных нами результатов и особенно по сравнению с пациентами 60-74 лет с ИМ+АГ+ССА. Среди пациентов со стабильной стенокардией уровень данного биомаркера воспаления оказался еще ниже [13].
Близкие к нашим данным параметры СРБ выявлены у пациентов 60-74 лет с ИМ в ближайшие 48 ч после выполнения чрескожного коронарного вмешательства в ретроспективном (СРБ=1,76±1,72 мг/л) и проспективном исследованиях (1,78±1,88 мг/л) [17]. Исследование, направленное на изучение связи между увеличением СРБ и частотой ИМ у пациентов с плановым чрескожным коронарным вмешательством в ретроспективном и проспективном этапах, представило доказательства того, что повышенные уровни СРБ и других биомаркеров воспаления были значимыми факторами, влияющими на возникновение ИМ и особенно после корректировки факторов, связанных с процедурными характеристиками.
У пациентов с ИМ с подъемом сегмента ST через 24 ч после появления симптомов, содержание СРБ составило 15,0 мг/л, что подтвердило роль низкопорогового воспаления в генезе ИМ [18]. Кроме того, сообщается о более высоком уровне вчСРБ в сыворотке крови у пациентов с ИМ с подъемом сегмента ST (69,9 мг/л) [12] по сравнению с пациентами с ИМ без подъема сегмента ST (23,1 мг/л) [11] во время госпитализации в острую фазу заболевания и подчеркивается, что уровни вчСРБ могут быть простым и надежным маркером величины воспалительной реакции на некроз миокарда.
Уровень ICAM-1 у пациентов 40-80 лет с ИМ при госпитализации составляет 145 нг/мл [12], что существенно ниже, чем у пациентов с ИМ+АГ+ССА, обследованных в настоящей работе, и указывает на то, что при ССА содержание ICAM-1 статистически значимо выше, чем у пациентов с ИМ+АГ+ПА и с ИМ+АГ.
У пациентов с сердечно-сосудистыми заболеваниями (ССЗ) и ССА уровень вчСРБ был статистически значимо выше (1,66 мг/л), чем у пациентов без названного выше гериатрического синдрома — 1,13 мг/л (р<0,001) [8]. В других исследованиях также показаны более высокие уровни СРБ у пациентов с ССА и сердечно-сосудистой патологией [7, 19]. ССА тесно связан с сопутствующими ССЗ, и они могут иметь общие патофизиологические детерминанты [19], включая нейроэндокринные нарушения и вялотекущее хроническое воспаление [20]. Существуют доказательства двунаправленной связи между ССЗ и ССА. В длительных проспективных исследованиях показана, с одной стороны, связь ССА, СРБ и преждевременной смерти от сердечно-сосудистой патологии, а с другой стороны — кардиометаболического риска со снижением физической работоспособности у пожилых людей [21][22]. Высокий уровень вчСРБ у пациентов с ССА ассоциируется с высоким риском смерти от ССЗ [8]. После коррекции на возраст, хронические болезни почек, когнитивные функции и рацион питания, повышенный уровень вчСРБ у пациентов с ССА связан с 3-кратным увеличением риска развития сердечно-сосудистой патологии, что, по мнению авторов, указывает на прогностическую ценность вчСРБ в прогнозировании сердечно-сосудистых событий у пациентов с ССА.
Результаты метаанализа [23] также показали, что ССА и ПА представляют собой независимые факторы риска ССЗ у пожилых людей. Поэтому определение вчСРБ позволяет выявлять пациентов с ПА [24]. Мужчины с более высоким уровнем вчСРБ и наличием ССА чаще умирали к моменту последующего наблюдения, чем пациенты без ССА [19].
Средний уровень ICAM-1 у пациентов с ПА (276,7±91,5 нг/мл) и с ССА (325,3±131,2 нг/мл) был выше по сравнению с лицами без ССА (263,3±88,9 нг/мл); p<0,001 в обоих случаях [9]. Более высокие уровни ICAM-1 у пациентов с ССА, которые выявлены в этом исследовании, могут свидетельствовать о сопряженности повышенного содержания этого маркера воспаления с развитием ССА.
В развитии ИМ и ССА, как известно, решающую роль играет повреждение эндотелия [10], а ЭД предшествует этим заболеваниям и позволяет прогнозировать сердечно-сосудистые события. Среди медиаторов, продуцируемых эндотелием, наиболее важную роль играет NO [25]. В единичных работах впервые показана взаимосвязь между ЭД, оцениваемой по уровню NO, и ССА [10]. Эти результаты не только подтверждают известную взаимосвязь между ССА и ССЗ, но и то, что эта связь существует уже на очень ранней стадии ЭД. Кроме того, выявлено, что уровень ассиметричного диметиларгинина, являющегося эндогенным ингибитором NO-синтазы и используемого в качестве маркера ЭД [26], повышен у пациентов с атеросклерозом и ПА и у пациентов без атеросклероза, но с ССА [10]. У больных АГ 1-2-й ст. без ИМ и ССА при увеличении риска по шкале SCORE (Systematic Coronary Risk Evaluation) выявлены более высокие уровни стабильных метаболитов NO, эндотелина-1 [27], и VEGF [28]. Напротив, у пациентов с ИМ+АГ содержание NO2- снижено до 5,7±0,2 vs 8,6±0,3 мкмоль/л у здоровых людей, а NO3- до 12,0±0,2 vs 14,5±0,4 мкмоль/л, соответственно [29]. Однако у пациентов с ИМ+АГ+ССА эти показатели ЭД в предыдущих исследованиях не определялись.
Заключение
У пациентов пожилого возраста с ИМ+АГ+ССА по сравнению с пациентами ИМ+АГ+ПА и ИМ+АГ существенно выше в сыворотке крови уровни вчСРБ, ICAM-1, эндотелина-1, десквамированных эндотелиоцитов, VEGF, тогда как содержание NO2- и NO3- достоверно ниже. Сопряженность биомаркеров ЭД, согласно иерархичному кластерному анализу, также была более выражена у пожилых пациентов с ИМ+АГ+ССА, чем у пациентов с ИМ+АГ+ПА. Установленные различия в содержании маркеров воспаления и ЭД у пациентов с ИМ+АГ, ИМ+АГ+ПА и ИМ+АГ+ССА свидетельствуют об их сопряженности с ССА.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Гарганеева А. А., Округин С. А., Борель К.Н. и др. Инфаркт миокарда на рубеже двух столетий: демографические и социальные тенденции. Клиническая медицина. 2016;94(6):463-6. doi:10.18821/0023-2149-2016-94-6-463-466.
2. Лавринова Е. А., Брылякова Д. Н., Кухарчик Г. А. Влияние синдрома старческой астении на течение острого коронарного синдрома без подъема сегмента ST и исходы у пациентов пожилого и старческого возраста. Скорая медицинская помощь. 2020;21(2):48-54. doi:10.24884/2072-6716-2020-21-2-48-54.
3. Лутай Ю. А. Рассогласование суточных биоритмов артериального давления и частоты сердечных сокращений у пожилых больных инфарктом миокарда. Научные результаты биомедицинских исследований. 2021;7(1):80-5. doi:10.18413/2658-6533-2020-7-1-0-8.
4. Ткачёва О. Н., Котовская Ю. В., Феоктистова К. В. и др. Острый коронарный синдром в старческом возрасте: проблемы и нерешенные вопросы. Кардиоваскулярная терапия и профилактика. 2017;16(3):62-7. doi:10.15829/1728-8800-2017-3-62-67.
5. Соселия Н. Н., Багманова Н. Х., Виллевальде С. В. и др. Проявления синдрома старческой астении у пациентов старческого возраста и долгожителей с острым коронарным синдромом. Вестник российского университета дружбы народов. 2018;22(2):141-7. doi:10.22363/2313-0245-2018-22-2-141-147.
6. Tonet E, Pavasini R, Biscaglia S, et al. Frailty in patients admitted to hospital for acute coronary syndrome: when, how and why? Journal of geriatric cardiology. 2019;16(2):129-37. doi:10.11909/j.issn.1671-5411.2019.02.005.
7. Velissaris D, Pantzaris N, Koniari I, et al. C-Reactive Protein and Frailty in the Elderly: A Literature Review. J Clin Med Res. 2017;9(6):461-5. doi:10.14740/jocmr2959w.
8. Yao SM, Zheng PP, Wan YH, et al. Adding high-sensitivity C-reactive protein to frailty assessment to predict mortality and cardiovascular events in elderly inpatients with cardiovascular disease. Exp Gerontol. 2021;146:111235. doi:10.1016/j.exger.2021.111235.
9. Lee WJ, Chen LK, Liang CK, et al. Soluble ICAM-1, Independent of IL-6, Is Associated with Prevalent Frailty in Community-Dwelling Elderly Taiwanese People. PLoS One. 2016;11(6):e0157877. doi:10.1371/journal.pone.0157877.
10. Alonso-Bouzon C, Carcaillon L, Garcia-Garcia FJ, et al. Association between endothelial dysfunction and frailty: the Toledo Study for Healthy Aging. Age (Dordr). 2014;36(1):495-505. doi:10.1007/s11357-013-9576-1.
11. Roumeliotis S, Veljkovic A, Georgianos PI, et al. Association between Biomarkers of Oxidative Stress and Inflammation with Cardiac Necrosis and Heart Failure in Non-ST Segment Elevation Myocardial Infarction Patients and Various Degrees of Kidney Function. Oxid Med Cell Longev. 2021;2021:3090120. doi:10.1155/2021/3090120.
12. Zhang Y, Shao T, Yao L, et al. Effects of tirofiban on stent thrombosis, Hs-CRP, IL-6 and sICAM-1 after PCI of acute myocardial infarction. Exp Ther Med. 2018;16(4):3383-8. doi:10.3892/etm.2018.6589.
13. Прудников А. Р. Оценка риска развития острого коронарного синдрома на основе исследования профиля цитокинов и протеолитической активности сыворотки крови. Иммунопатология, аллергология, инфектология. 2019;1:25-33. doi:10.14427/jipai.2019.1.25.
14. Roffie M, Patrono C, Collet JP, et al. 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: Task Force for the Management of Acute Coronary Syndromes in Patients Presenting without Persistent ST-Segment Elevation of the European Society of Cardiology (ESC). Eur Heart J. 2016;37(3):267-315. doi:10.1093/eurheartj/ehv320.
15. Чазова И.Е., Жернакова Ю. В. Клинические рекомендации. Диагностика и лечение артериальной гипертонии. Системные гипертензии. 2019;16(1):6-31. doi:10.26442/2075082X.2019.1.190179.
16. Fried LP, Tangen CM, Walston J, et al. Frailty in older adults: evidence for a phenotype. J. Geront. Med. Sci. 2001;56(3):146-56. doi:10.1093/gerona/56.3.m146.
17. Zhao L, Li Y, Xu T, et al. Impact of increased inflammation biomarkers on periprocedural myocardial infarction in patients undergoing elective percutaneous coronary intervention: a cohort study. J Thorac Dis. 2020;12(10):5398-410. doi:10.21037/jtd-20-1605.
18. Ries W, Torzewski J, Heigl F, et al. C-Reactive Protein Aphe-resis as Anti-inflammatory Therapy in Acute Myocardial Infarction: Results of the CAMI-1 Study. Front Cardiovasc Med. 2021;8:591714. doi:10.3389/fcvm.2021.591714.
19. McKechnie DG, Papacosta AO, Lennon LT, et al. Associations between inflammation, cardiovascular biomarkers and incident frailty: the British Regional Heart Study. Age Ageing. 2021;50(6):1979-87. doi:10.1093/ageing/afab143.
20. Stewart R. Cardiovascular Disease and Frailty: What Are the Mechanistic Links? Clin Chem. 2019;65(1):80-6. doi:10.1373/ clinchem.2018.287318.
21. Liu ZY, Wang ZD, Li LZ, et al. Association of CRP gene polymorphisms with CRP levels, frailty and co-morbidity in an elderly Chinese population: results from RuLAS. Age Ageing. 2016;45(3):360-5. doi:10.1093/ageing/afw041.
22. Hwang AC, Liu LK, Lee WJ, et al. Association of Frailty and Cardiometabolic Risk Among Community-Dwelling MiddleAged and Older People: Results from the I-Lan Longitudinal Aging Study. Rejuvenation Res. 2015;18(6):564-72. doi:10.1089/rej.2015.1699.
23. Veronese N, Cereda E, Stubbs B, et al. Risk of cardiovascular disease morbidity and mortality in frail and pre-frail older adults: Results from a meta-analysis and exploratory meta-regression analysis. Ageing Res Rev. 2017;35:63-73. doi:10.1016/j.arr.2017.01.003.
24. Liang YD, Liu Q, Du MH, et al. Urinary 8-oxo-7,8-dihydroguanosine as a potential biomarker of frailty for elderly patients with cardiovascular disease. Free Radic Biol Med. 2020;152:248-54. doi:10.1016/j.freeradbiomed.2020.03.011.
25. Assar ME, Angulo J, Vallejo S, et al. Mechanisms involved in the aging-induced vascular dysfunction. Front Physiol. 2012;3:132. doi:10.3389/fphys.2012.00132.
26. Stuhlinger MC, Oka RK, Graf EE, et al. Endothelial dysfunction induced by hyperhomocyst(e)inemia: role of asymmetric dimethylarginine. Circulation. 2003;108(8):933-8. doi:10.1161/01.CIR.0000085067.55901.89.
27. Подзолков В. И., Брагина А. Е., Дружинина Н. А. Прогностическая значимость маркеров эндотелиальной дисфункции у больных гипертонической болезнью. Российский кардиологический журнал. 2018;(4):7-13. doi:10.15829/1560-4071-2018-4-7-13.
28. Чукаева И.И., Спирякина Я.Г., Орлова Н.В. и др. Оценка маркёров воспаления и эндотелиальной дисфункции у пациентов с артериальной гипертензией на фоне достижения целевого уровня артериального давления. Клиническая лабораторная диагностика. 2018;63(6):337-40.
29. Фуштей И. М., Голдовский Б. М., Мочёный В. О. и др. Современные представления о механизмах поражения сосудов при гипертонической болезни и атеросклерозе. Медицина неотложных состояний. 2015;69(6):26-29.
Об авторах
Н. М. АгарковРоссия
Агарков Николай Михайлович — доктор медицинских наук, профессор кафедры биомедицинской инженерии, старший научный сотрудник лаборатории "Проблемы старения".
Курск; Белгород
О. И. Охотников
Россия
Охотников Олег Иванович — доктор медицинских наук, профессор кафедры лучевой диагностики и терапии.
Курск
А. В. Голиков
Россия
Голиков Альберт Витальевич — доктор медицинских наук, доцент кафедры хирургических болезней № 1.
Курск
Л. В. Колпина
Израиль
Колпина Лола Владимировна — кандидат социологических наук, доцент кафедры социальных технологий.
Тель-Авив
В. И. Коломиец
Россия
Заочный аспирант.
Курск
Что известно о предмете исследования?
- Около трети пациентов, госпитализированных с острым коронарным синдромом, составляют лица старческого возраста, среди которых широко распространен основной гериатрический синдром — синдром старческой астении (ССА).
- Неизвестными остаются изменения системы воспаления и эндотелиальной дисфункции у пациентов пожилого возраста с инфарктом миокарда (ИМ)+артериальной гипертензией (АГ)+ССА, поскольку в предыдущих исследованиях эти показатели рассматривались раздельно среди пациентов с ИМ, при ССА и АГ.
- Раздельно представлены в современных публикациях сведения о биомаркерах воспаления, эндотелиальной дисфункции у пациентов только с ИМ (без АГ и ССА), что не позволяет оценить влияние сочетания ИМ, АГ и ССА на нарушения в системе воспаления и эндотелия.
Что добавляют результаты исследования?
- У пациентов с ИМ+АГ+ССА по сравнению с ИМ+АГ и ИМ+АГ+преастения (ПА) достоверно выше уровень С-реактивного белка, определенного высокочувствительным методом, молекулы межклеточной адгезии, эндотелина-1, десквамированных эндотелиоцитов, фактора роста эндотелия сосудов и снижены уровни нитрита NO2-и нитрата NO3-.
- Выявленные различия в уровнях показателей воспаления и эндотелиальной дисфункции у пациентов с ИМ+АГ+ССА указывают на то, что ССА ассоциируется с более высоким уровнем вышеназванных показателей.
Рецензия
Для цитирования:
Агарков Н.М., Охотников О.И., Голиков А.В., Колпина Л.В., Коломиец В.И. Биомаркеры воспаления и эндотелиальной дисфункции у пожилых пациентов с инфарктом миокарда, артериальной гипертензией и синдромом старческой астении. Кардиоваскулярная терапия и профилактика. 2023;22(3):3364. https://doi.org/10.15829/1728-8800-2023-3364
For citation:
Agarkov N.M., Okhotnikov O.I., Golikov A.V., Kolpina L.V., Kolomiets V.I. Biomarkers of inflammation and endothelial dysfunction in elderly patients with myocardial infarction, hypertension and frailty. Cardiovascular Therapy and Prevention. 2023;22(3):3364. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3364





















































