1. 引言
胃癌是常见的癌症之一。世界卫生组织数据显示,2020年全球新发胃癌病例108.9万例,占全球新发癌症病例的5.6%;死亡病例76.9万例,占死亡病例的7.7%。中国胃癌病例47.8万例,死亡37.4万例,分别占全球胃癌病例和死亡人数的43.94%和48.62% [1] 。虽然2004~2020年中国胃癌标化死亡率呈下降趋势,但由于老龄化趋势严峻,胃癌在中国的发病率、致死率仍然较高 [2] 。癌症的早发现、早诊断、早治疗是降低死亡风险和延长生存期的主要策略,但胃癌早期病例仅占10%~20% [3] ,大部分患者确诊时处于中晚期,整体预后较差。胃癌早期多无明显特殊症状,起病较隐匿,临床上通常采用保守的全身综合治疗方法,如放疗、化疗、靶向药物治疗以及生物免疫治疗。然而,放化疗副作用较大,靶向药物及免疫治疗适应症有限、费用昂贵 [4] [5] [6] 。因此,急需开发新的胃癌治疗药物。
中医药作为我国国粹,因其具有“高效、低毒、多靶点、低成本”等优势,被广泛应用于各种肿瘤的治疗 [7] ,如槐耳颗粒 [8] 、斑蝥胶囊 [9] 等。中医药通过抑制细胞增殖、细胞侵袭与转移、血管生成,诱导细胞凋亡及自噬,提升肿瘤患者的免疫力及增敏化疗药物的敏感性而发挥临床抗癌疗效 [10] 。大量的临床资料表明,化疗配合中药及其有效活性成分治疗肿瘤比单纯化疗具有更好的疗效和更低的不良反应 [11] [12] [13] 。胃宁颗粒(Weining Granules, WNG)作为中药复方制剂,主要由黄芪、莪术、茯苓、枸杞等药材组成。临床数据表明胃宁颗粒在胃癌治疗中表现突出,在改善胃癌患者临床症状、延长生存期、以及减轻化疗后不良反应等方面,具有确切的临床疗效 [14] ,然而其治疗胃癌的物质基础及作用机制仍未完全阐明。
网络药理学的概念由英国安德鲁·霍普金斯教授于2007年首次提出 [15] 。该方法结合药理学、分子生物学、医学、生物信息学以及统计学探讨药物对疾病的作用机制 [16] 。网络药理学因其多靶点、多通路、可视化等特点已被广泛地应用于预测药物成分及探讨疾病的潜在作用机制 [17] 。例如,李媛媛等人运用网络药理学并结合实验验证探讨了江南卷柏治疗喉癌的作用机理 [18] 。Fan等通过网络药理学解析了左金胶囊抑制结肠癌的作用机制 [19] 。本研究基于网络药理学、蛋白互作分析、富集分析、差异表达分析、生存分析等生物信息学方法,并结合液相色谱–质谱联用及蛋白质组技术揭示胃宁颗粒治疗胃癌的有效成分及作用机制,绘制“胃宁颗粒–成分–靶点–通路–胃癌”互作网络图,进一步通过分子对接揭示胃宁颗粒有效成分对靶点的作用。
2. 方法
2.1. 胃宁颗粒主要活性成分的筛选及靶点预测
本课题组前期通过色谱–质谱联用技术获得胃宁颗粒主要活性成分23个 [20] (表1)。随后,将得到的活性成分名称输入Pubchem数据库(https://pubchem.ncbi.nlm.nih.gov/)进行检索,获得该化合物的2D结构,将2D结构或SMILES结构式导入Swiss Target Prediction数据库(http://www.swisstargetprediction.ch/),以置信度probability > 0为筛选阈值预测化合物潜在靶点。
2.2. 胃宁颗粒调控的差异表达蛋白
本论文使用的胃癌细胞SGC-7901购自于中国科学院细胞库,并培养在含10%胎牛血清及100 U/ml的青霉素及链霉素的DMEM培养基中。使用浓度为0.1 g/ml的胃宁颗粒处理SGC-7901细胞48小时,获取细胞总蛋白后采用TMT标记定量蛋白质组学揭示胃宁颗粒导致的蛋白表达谱变化。随后,以表达倍数|Fold Change| ≥ 1.2,P < 0.05为筛选标准获得胃宁颗粒调控的差异表达蛋白。
2.3. 交集靶点的确定和富集分析
首先,将化合物预测靶点和差异表达蛋白导入Venny 2.1.0 (http://bioinfogp.cnb.csic.es/tools/venny/)绘制韦恩图,筛选出交集靶点蛋白。其次,将交集靶点蛋白导入Metascape平台(https://metascape.org/gp/index.html),以P < 0.01为筛选标准,分别进行GO (gene ontology)生物功能分析和KEGG (kyoto encyclopedia of genes and genomes)通路富集分析,其中GO功能分析包括生物过程(biological process, BP)、分子功能(molecular function, MF)及细胞组成(cellular component, CC),将获得的数据结果应用于微生信平台(http://www.bioinformatics.com.cn)绘制GO功能分析柱状图和KEGG通路富集分析条形图。
2.4. “胃宁颗粒–成分–靶点–通路–胃癌”网络的构建及核心成分的筛选
将收集并归类好的主要活性成分、交集靶点和信号通路导入至Cytoscape 3.9.1中,构建“胃宁颗粒–成分–靶点–通路–胃癌”网络,再利用CytoHubba插件工具对成分节点进行拓扑分析,计算出相关参数,以介数中心性(Betweenness Centrality)、接近中心性(Closeness Centrality)、度值(Degree)三类参数同时大于平均值为标准筛选核心成分。
2.5. 核心靶点的筛选
将交集靶点蛋白输入String (http://string-db.org/)数据库,将物种设置为人(Homo sapiens),置信度设置为“0.4”。取蛋白间的相互作用信息,构建蛋白–蛋白互作(protein-protein interaction, PPI)网络图,导出图片为TSV格式并导入Cytoscape 3.9.1软件,利用cytoHubba插件工具对其进行拓扑参数分析,选择介数中心性、接近中心性、度值三类参数同时大于平均值的靶点作为核心靶点。
2.6. 核心靶点的差异分析、生存分析及受试者操作特征曲线(ROC)分析
从TCGA数据库中下载并整理TPM格式的胃腺癌RNAseq数据及胃癌病人临床信息。去重复后,使用R (4.2.1)的“stats”包进行差异统计分析,并使用“ggplot2”包对结果进行可视化。使用R (4.2.1)的“survminer”包进行生成分析。通过运行R (4.2.1)的“pROC”开展ROC分析。
2.7. 分子对接
首先从PDB数据库(https://www.rcsb.org/)中获取核心靶点的分子结构,利用Pymol软件对结构去水、去配体后保存数据;从Pubchem数据库中获取核心成分的3D结构,利用Open Babel 3.1.1软件将SDF格式转化为mol2格式。将准备好的靶点蛋白与化合物结构导入Auto Dock Tools 1.5.7中进行加氢、设置扭转键等操作最后转化为PDBQT的格式保存,将受体和配体的PDBQT文件导入Auto Dock Tools 1.5.7进行分子对接。取分子对接结合能最低的结合模型导入Pymol中进行可视化。
2.8. 细胞增殖及Transwell实验
取对数生长期的SGC-7901细胞按5000/孔种植于96孔板,24小时后加入不同浓度WNG处理48小时。随后每孔加入10微升CCK-8溶液,继续培养2小时后测量450 nm处吸光值。Transwell小室(ECM550,Chemicon, USA)事先用无血清培养基水化至少1小时。将不同处理细胞(5 × 104个细胞)接种到每个小室(上室)中。将含有10% FBS的DMEM培养基加载到底部室中。24小时后,取出插入膜上表面的细胞,同时用甲醇固定下表面的细胞、用结晶紫染色并通过显微镜计数。
3. 结果
3.1. 胃宁颗粒(WNG)剂量依赖性抑制胃癌细胞增殖及迁移
为了检测胃宁颗粒对胃癌细胞增殖及迁移的影响,我们开展了CCK-8及transwell实验。结果显示,胃宁颗粒剂量依赖性地抑制胃癌细胞增殖(图1(A))。Transwell结果提示胃宁颗粒显著抑制胃癌细胞的迁移(图1(B))。
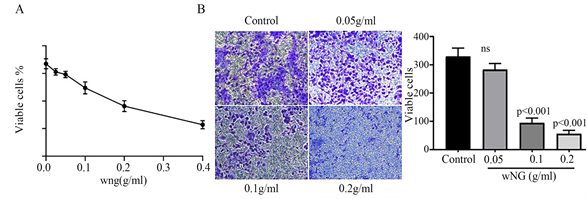
Figure 1. WNG inhibited the proliferation and migration of gastric cancer cells in a dose-dependent manner. (A) Proliferation curve of SGC7901; (B) represent images of cell migration and statistics
图1. 胃宁颗粒剂量依赖性抑制胃癌细胞增殖与迁移。(A) 细胞增殖曲线图;(B) 细胞迁移结果及统计
3.2. 药物成分的初步筛选和成分靶点的获取
借助色谱–质谱联用技术,通过比对目标化合物与数据库中化合物的片段模式,利用SCIEX OSV1.4软件我们从胃宁颗粒中共鉴定出23个主要活性成分,将活性成分导入Swiss Target Prediction数据库中进行靶点预测,以置信度probability > 0为阈值筛选得到437个成分相关靶点,其中甜菜碱(Betaine)无符合阈值条件的相关靶点,故胃宁颗粒中实含22个有效成分。

Table 1. The main active compounds in WNG
表1. 胃宁颗粒中的主要活性成分
3.3. 胃宁颗粒处理下胃癌细胞SGC-7901蛋白表达谱变化
根据本课题组前期研究 [20] ,以|Fold Change| > 1.2,P < 0.05为标准,获得619个胃宁颗粒处理下胃癌细胞差异表达蛋白(图2)。
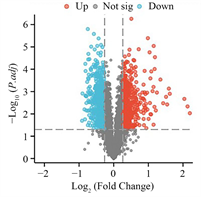
Figure 2. Volcano plot of differentially expressed proteins induced by WNG
图2. 胃宁颗粒诱导的胃癌差异表达蛋白火山图
3.4. 交集靶点的确定及GO/KEGG分析
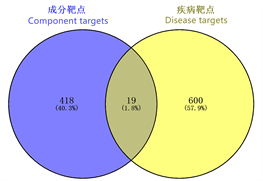
Figure 3. Venn diagram of drug components and disease intersection targets
图3. 药物成分与疾病交集靶点的韦恩图

Figure 5. KEGG pathway enrichment analysis
图5. KEGG通路富集分析
将预测的成分靶点与差异表达蛋白取交集,共得到19个交集靶点(图3)。将19个交集靶点导入Metascape数据库中进行GO分析和KEGG富集分析(P < 0.01且靶点数 ≥ 3)。GO富集分析结果显示19个靶点共富集出生物学过程(BP) 57条、细胞组分(CC) 13条、分子生物功能(MF) 9条。根据P值筛选出BP、CC和MF各前5条作柱状图,主要涉及对外源性刺激的反应、神经元凋亡过程的调节、细胞分裂、线粒体膜、线粒体包膜等生物学过程(图4)。KEGG通路富集分析获得11个信号通路,主要涉及PI3K-Akt信号通路、癌症途径通路、细胞凋亡通路、类固醇生物合成信号通路及化学致癌通路等等(图5)。
3.5. “胃宁颗粒–成分–靶点–通路–胃癌”网络的构建及核心成分的筛选
将19个交集靶点、22个有效成分及富集前10的KEGG信号通路导入Cytoscape 3.9.1中,构建“胃宁颗粒–成分–靶点–通路–胃癌”网络(图6)。图中有53个节点,110条边。利用cytoHubba插件工具计算节点拓扑参数,选择介数中心性、接近中心性、度值三类参数同时大于平均值的化学成分作为本次研究的核心成分,即以同时满足betweenness > 0.104,closeness > 0.218,degree > 2.22为阈值筛选出3个核心成分,分别是:槲皮素(Quercetin)、莪术二酮(Curdione)、刺芒柄花素(Formononetin)。

Figure 6. WNG-component-target-pathway-gastric cancer network
图6. 胃宁颗粒–成分–靶点–通路–胃癌网络图
3.6. 核心靶点的筛选
将交集靶点蛋白输入STRING数据库,构建蛋白–蛋白互作(PPI)网络并利用Cytoscape 3.9.1软件得到可视化的PPI网络(图7)。图中共有17个节点,30条边,网络中节点的颜色越深、形状越大,就代表该靶点的度值越大,在网络中的重要性越高。利用cytoHubba插件计算拓扑参数,以介数中心性、接近中心性、度值三类参数同时大于平均值为阈值,筛选出本次研究的核心靶点(表2)。度值排名前三的核心靶点是:VEGFA、BCL2L1、CDK4。
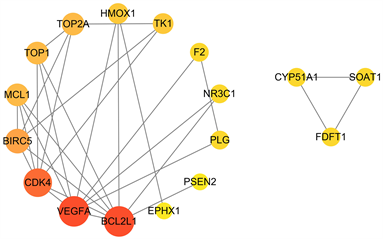
Figure 7. PPI network of the intersection targets
图7. 交集靶点PPI网络

Table 2. Topological analysis results of protein targets in PPI network
表2. PPI网络蛋白靶点拓扑分析结果
3.7. 核心靶点在胃癌中的表达、预后及ROC分析
进一步的,我们通过生物信息学评估了排名前3的核心靶点在胃癌发生中的潜在作用。首先,通过差异表达分析发现,与癌旁组织相比,VEGFA、BCL2L1、CDK4皆显著高表达于胃癌组织(图8(A));其高表达与胃癌患者预后不良显著正相关(图8(B));ROC分析结果提示这三个核心基因是胃癌良好的临床预测指标(图8(C))。
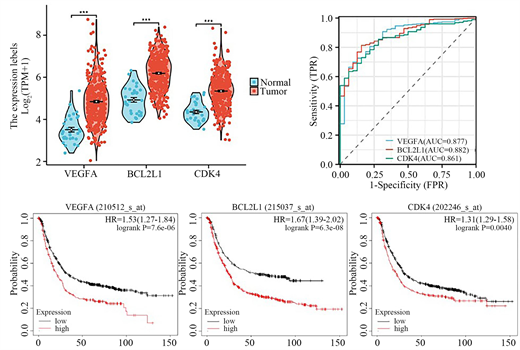
Figure 8. Expression and prognosis of key targets in GC. (A) DEGs analysis; (B) ROC analysis; (C) Prognosis analysis
图8. 核心基因在胃癌中的表达及预后分析。(A) 差异表达分析;(B) ROC分析;(C) 预后分析
3.8. 分子对接
将胃宁颗粒核心成分(莪术二酮、刺芒柄花素、槲皮素)与核心靶点(VEGFA、BCL2L1、CDK4)做分子对接。结果显示:VEGFA、BCL2L1、CDK4分别与莪术二酮、刺芒柄花素、槲皮素对接活性最好(表3、图9)。

Table 3. The molecular docking score of core targets and core components
表3. 核心靶点与核心成分的分子对接分数
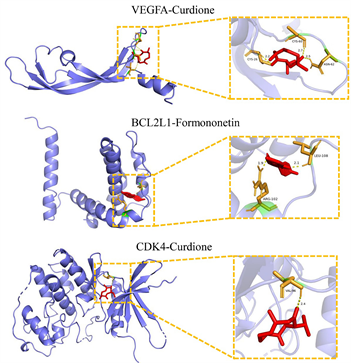
Figure 9. The molecular docking between core targets and compounds
图9. 核心蛋白与核心成分的分子对接
4. 讨论
胃宁颗粒是全国名老中医蓝青强教授基于多年临床经验研制而成的中药复方,对胃癌有很好的临床治疗效果 [14] 。相关研究结果表明,胃宁颗粒能抑制胃癌细胞的增殖,诱导胃癌细胞凋亡 [20] 。然而,目前胃宁颗粒治疗胃癌的药效基础及作用机制仍未阐明。本研究基于整合生物信息学(网络药理学、分子对接、差异表达分析、预后分析及ROC分析)并结合实验(液相色谱–质谱联用及蛋白质组学)系统探讨了胃宁颗粒治疗胃癌的有效活性成分、作用靶点及信号通路。结果显示,胃宁颗粒抗胃癌主要活性成分23个,作用于19个胃癌相关靶点。作用靶点主要富集在PI3K-Akt信号通路、癌症途径通路、细胞凋亡通路、类固醇生物合成信号通路及化学致癌通路等相关通路。分子对接结果提示胃宁颗粒治疗胃癌的核心成分是刺芒柄花素、槲皮素、莪术二酮,核心靶点则为VEGFA、BCL2L1及CDK4。
网络药理学基于其“多成分–多靶点–多通路”的原理被广泛运用于中药复方药效的解析。目前,在大部分网络药理学的相关研究中,科研工作者选取的化合物分子(活性成分)大部分源自文献报道和相关网络数据库,如TCMSP、TCMID、GeneCards及OMIM等,并未进行真正的实验研究(分离提取及鉴定)。由于提取工艺和药物/植物资源产地不同网络数据库中已报道成分未必在该种药用提取物中存在,这会导致构建的网络及预测的作用机制不够准确。在本研究中,我们通过液相色谱–质谱联用实验确认胃宁颗粒的主要成分,通过蛋白质组学获得胃宁颗粒导致的差异表达蛋白作为作用靶点。相较于传统网络药理学,我们的结果更为真实、可靠。
本研究发现的三个核心靶点VEGFA、BCL2L1及CDK4在胃癌的发生发展中扮演了至关重要的角色。血管生成是肿瘤增殖及转移最重要的环节之一,调控血管生成的基因往往是肿瘤治疗的潜在靶点 [21] 。研究报道显示VEGFA可以诱导肿瘤血管生成,从而促进胃癌的生长与转移 [22] 。目前,已有包括Ramucirumab [23] 、Apatinib [24] 在内的多种VEGFA靶向治疗胃癌药物。BCL2L1是BCL-2家族的抗凋亡成员,在胃癌组织中高表达,下调BCL2L1抑制胃癌细胞增殖 [25] 。CDK4参与细胞周期调控,其高表达是胃癌细胞异常增殖的重要原因之一 [26] 。在本研究中,我们发现三个核心成分莪术二酮(Curdione)、刺芒柄花素(Formononetin)及槲皮素(Quercetin)与以上三个核心靶点有很好的对接活性。已有研究结果表明刺芒柄花素及槲皮素能下调VEGFA的表达,抑制血管形成 [27] [28] 。槲皮素能通过下调BCL2L1诱导胃癌细胞凋亡 [29] 。槲皮素及刺芒柄花素能下调CDK4的表达诱导细胞周期阻滞 [30] [31] 。我们的研究一方面验证了前人已发表的结果,另一方面发现了潜在的蛋白抑制物。
PI3K/Akt信号通路是各种类型癌症的主要信号通路,通过影响细胞存活、转移和代谢从而调控癌症的发生与发展 [32] 。例如,PI3K/Akt的持续活化促进非小细胞肺癌的发生及发展 [33] 。异常激活的PI3K/Akt通路可以诱导EMT进而促进胃癌转移 [34] 。PI3K/Akt通路的异常活化是肝癌转移的主要因素 [35] 。TNF-ɑ可通过上调PI3K/Akt信号通路中关键因子,增强口腔鳞癌细胞侵袭转化能力 [36] 。因此,PI3K/AKT通路被认为是癌症最重要的靶点之一。
5. 结论
综上所述,本研究基于网络药理学及富集分析发现胃宁颗粒有效成分可能通过抑制PI3K/AKT通路活性从而降低胃癌细胞活性及侵袭。PI3K/AKT通路可能是胃宁颗粒抗胃癌主要作用机制。
基金项目
广西大学大学生创新创业训练计划项目(S202210593280)。
NOTES
*第一作者。
#通讯作者。