1. 引言
水体中的硝酸盐(
)污染已成为一个全球性的环境问题。人为活动(如农业中的过量施肥)是
污染的主要来源 [1] [2]。
污染会导致水华等生态环境问题的发生,也会渗入饮用水,威胁人类健康 [3]。美国环境保护局和欧盟委员会已经制定了饮用水中
浓度限值的规定,该限值应分别低于10 mg/L和11.3 mg/L
-N。
与各种去除
的物理化学方法(例如吸附、离子交换、反渗透)相比,生物脱氮是一种更具成本效益的方法 [4]。生物脱氮过程中,
作为电子受体,被反硝化微生物转化为无害的氮气,其中反硝化菌需要一个电子供体来提供电子和能量,因此它对反硝化过程至关重要 [5]。根据电子供体的类型,反硝化可分为异养反硝化和自养反硝化。异养反硝化使用有机化合物作为电子供体,包括液相碳源(例如醋酸盐、甲醇、葡萄糖等)和固相碳源(例如纤维素、聚乳酸、聚己内酯等) [6] [7];自养反硝化使用无机化合物,包括氢(H2)、还原硫化合物(例如硫化物、元素硫和硫代硫酸盐)、亚铁(Fe2+)、硫化铁(例如FeS、Fe1−xS和FeS2)作为电子给体 [6] [8]。一般来说,由于异养细菌的生长速度较快,异养反硝化比自养反硝化具有更高的硝酸盐去除率。然而,外部有机物的输入增加了二次污染的风险。因此,自养反硝化被认为是一种替代工艺 [9] [10]。
电子供体的选择对反硝化效率有很大影响,近几十年来,人们广泛研究了基于不同电子供体的反硝化可行性和代谢机理 [11] [12] [13] [14] [15]。一些研究人员对基于无机电子供体的自养反硝化进行了综述,但对各种电子供体,包括有机物和无机物的全面介绍和比较仍缺乏综述。因此,本文综述了生物脱氮的各种电子供体的最新进展,比较了不同电子供体的优缺点,并介绍了基于各种电子供体的反硝化中试和全规模应用的最新进展。
2. 脱氮概述
生物脱氮是指利用微生物的反硝化作用将
还原为气态N2的过程。还原顺序为:
®
® NO ® N2O ® N2,由特定酶催化的四个步骤:硝酸还原酶(NAR)、亚硝酸盐还原酶(NIR)、一氧化氮还原酶(NOR)和氧化亚氮还原酶(N2OR)。电子由碳源(即电子供体)经电子传递链传递至最终电子受体(硝酸盐),以此完成了
的生物还原 [16] [17]。
3. 不同电子供体
有机电子供体由液相碳源和固相碳源组成,而无机电子供体主要由氢、还原硫化合物、铁和铁硫化物组成 [18] [19] [20]。反硝化电子供体的分类如图1所示。
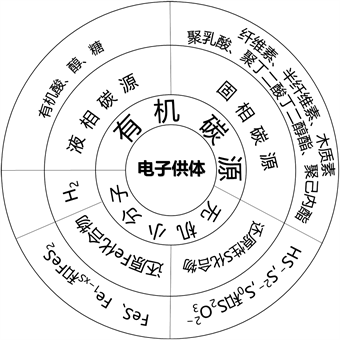
Figure 1. Types of denitrification carbon sources [19]
图1. 反硝化碳源的种类 [19]
3.1 有机电子供体
液相碳源,包括有机酸、醇、糖,其中,醋酸盐、甲醇、乙醇和葡萄糖是最常用的。
有机酸:以醋酸盐为电子供体的反硝化反应如下所示:
(1)
在反应中,醋酸盐首先转化为乙酰辅酶A,然后乙酰辅酶A可以通过进入TCA循环直接被反硝化细菌使用。对于以丙酸作为电子供体的反应,丙酸首先转化为丙酰辅酶A。通过一系列的酶羧化反应,丙酰辅酶a转化为琥珀酰辅酶a,可供微生物使用。据报道,醋酸盐的利用速度通常快于丙酸盐,这导致更高的反硝化速率 [21]。此外,使用混合VFA基质的反硝化速率显著高于使用单一VFA基质(例如醋酸盐、丙酸盐、丁酸盐和戊酸盐)的反硝化速率。当混合VFA足够时,反硝化速率遵循零级动力学,达到每天0.754 g NO3-N/g VSS [22]。
酒精:醇(例如甲醇、乙醇和甘油)可以被反硝化菌用作电子供体。甲醇和乙醇是常见的电子给体,其反应如下所示:
(2)
(3)
在反应过程中,甲醇和乙醇首先分别转化为甲醛和乙醛。然后甲醛转化为乙醛酸,而乙醛转化为乙酸。它们最终都转化为乙酰辅酶A,然后进入TCA循环。就乙醇而言,约40%的乙醇用于同化目的。由于甲醇是所有液体有机碳源中最便宜的,因此它已广泛用于废水处理 [23]。
糖类:单糖(如葡萄糖、木糖和甘露糖)和双糖(如蔗糖、乳糖和纤维二糖)均可作为反硝化菌的电子供体。其中,葡萄糖是最常用的电子供体,其反应如下:
(4)
在此过程中,葡萄糖首先转化为丙酮酸,然后转化为乙醇。葡萄糖作为电子供体的反硝化速率低于醋酸盐。此外,当使用葡萄糖作为电子供体时,异化硝酸盐还原为铵途径将变得显著,导致铵产量增加;而使用醋酸盐或乙醇作为电子供体,则以反硝化途径为主。此外,与醋酸盐和乙醇相比,使用葡萄糖作为电子供体的
积累和N2O生成更高 [24]。
当可溶性有机物过量时,向反硝化反应器中添加可溶性液相碳源会导致二次有机污染的风险。因此,近年来,使用固相碳源(包括天然木质纤维材料和合成可生物降解聚合物)作为电子供体的固相反硝化已成为
去除的前景工艺 [25] [26] [27] [28]。固相脱氮示意图如图2所示。
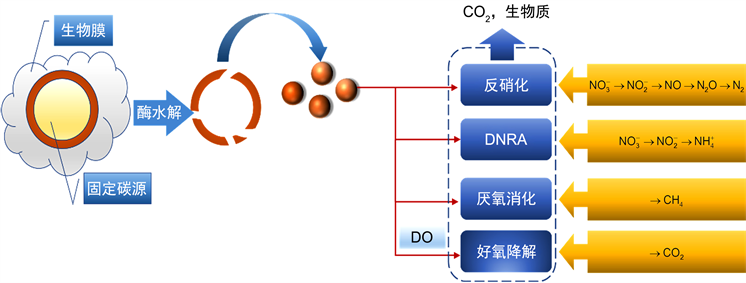
Figure 2. Schematic diagram of solid-phase denitrification [28]
图2. 固相反硝化示意图 [28]
天然生物聚合物材料:一系列含有纤维素、半纤维素或木质素的天然生物聚合物材料(例如淀粉、棉花、麦秸、稻壳、锯末和木屑)可以用作固相反硝化的电子供体。研究了以木质纤维材料为电子供体的反硝化机理:木质纤维材料首先被酶水解成小分子有机化合物(例如葡萄糖),然后被反硝化细菌使用 [29]。在纤维素、半纤维素和木质素中,纤维素最容易被微生物利用,其次是半纤维素,木质素最难被利用。一些反硝化细菌甚至可以直接使用木质纤维材料。使用木质纤维材料作为电子供体的反硝化速率通常低于使用葡萄糖和乙醇的反硝化速率 [30]。天然木质纤维材料不仅可以作为反硝化细菌的电子供体和碳源,而且由于其较大的可接近表面积,还可以作为生物膜形成的载体。Hellman等人 [31] 发现,莎草和秸秆反应器中
的去除率是木片反应器的3.3倍。这主要是由于木片反应器中的木质素(难以被微生物利用)含量高于莎草和稻草反应器。提高碳消化率是提高天然木质纤维原料反应速率的有效途径。酸或碱预处理可以提高其碳消化率。研究人员报告称,用石灰和过氧乙酸预处理后,以木屑为碳源的反硝化速率增加了4.5~4.8倍。此外,Fan等人 [32] 发现,秸秆的碱预处理增强了反应器中的COD释放,并提高了反硝化速率。
合成可生物降解聚合物:合成的可生物降解聚合物,如聚乳酸(PLA)、聚丁二酸丁二醇酯(PBS)、聚己内酯(PCL)、聚羟基烷酸酯(PHA)、聚-3-羟基丁酸(PHB)和3-羟基丁酸-共羟丙基酯(PHBV)被证明是固相反硝化的合适电子供体。与天然木质纤维材料类似,酶水解是降解合成聚合物的第一步也是关键步骤。可生物降解聚合物的水解速率是影响脱氮速率的主要因素,乙酸是这些聚合物的主要水解产物之一 [33]。
与棉花、稻草和木片相比,这些合成聚合物释放的溶解有机碳(DOC)较低。在处理硝酸盐污染的地下水和低C/N废水(即二级出水)中,使用合成可生物降解聚合物进行反硝化已得到广泛研究。在这些研究中,当进水
浓度在25至60 mg/L之间时,反硝化速率在0.19至3.80 g N/L∙d范围内 [34]。一些研究将合成的可生物降解聚合物与廉价的有机物质(如竹粉、淀粉和稻壳)混合,以降低成本。Yang等人 [35] 发现,与单个PHBV系统相比,PHBV稻壳和PHNV锯屑系统的启动速度更快,脱氮率更高。
3.2. 无机电子供体
无机电子供体:如H2、还原硫化合物(如HS−,S2−,S0和
),亚铁和硫化铁(例如FeS、Fe1−xS和FeS2)已开发用于自养反硝化工艺,更适合于低碳氮比水处理 [8] [36]。
氢(H2)是自养反硝化菌的替代电子供体,使用H2作为电子供体的反硝化反应如下所示:
(7)
大多数氢营养反硝化细菌隶属于副球菌属、红细胞属、不动杆菌属和假单胞菌属。氢营养反硝化细菌的最佳pH值为7.6~8.6。由于氢营养反硝化消耗H+,因此该过程需要控制pH值。
H2具有较高的能量,但其在水介质中的低溶解度限制了其生物利用度。此外,H2的安全问题也是大规模应用的限制。近年来,膜技术的发展为硝酸盐污染水的氢脱氮处理提供了一条有效途径,它可以增强氢气从气相到液相的传质。利用中空纤维膜作为气体渗透膜进行氢气扩散已得到广泛研究。Park等人 [37] 构建了中空纤维膜生物膜反应器(HF-MBfR),其中反硝化效率高于98%,最大反硝化速率为2.42 g-N/m3∙d。
除了通过膜曝气产生氢气外,还可以在电极上产生氢气,这可以减少氢气的浪费。在生物电化学系统(BES)中,阴极生物膜上的反硝化细菌可以利用电解在电极上产生的氢气。Zhu等人 [38] 发现,阴极而不是电化学产生的H2是BES中的主要电子供体,因为硝酸盐还原速率比H2生成速率高100倍。值得注意的是,几种自养反硝化菌,如脱氮硫杆菌、嗜碱假单胞菌和铜绿假单胞菌,可以直接吸收电极电子进行反硝化。学者研究了双室BES反应器中的阴极反硝化性能,该反应器达到0.017~0.062 g
-N/L∙d处理合成地下水时。Mahl等人 [39] 构建了一个两级连续生物催化反硝化系统,在0.066至0.200 NO3-N/L∙d的负荷率下,实现了较高的
去除率(>95%)。
由于传统的BES反应器(具有两个电极)的硝酸盐去除能力受到阴极表面积的限制,近年来开发了三维生物膜电极反应器(3D-BER)。在3D-BER中,活性炭(AC)或与其他物质混合的AC填充在阳极和阴极之间,用作第三个双极电极。这种第三电极不仅为微生物生长提供了高比表面积,而且还增加了氢气产量。与2D-BER相比,3D-BER的电流效率和反硝化速率分别提高了76%和35% [40]。
还原无机硫化合物:一些化石自养细菌可以使用还原硫化合物(例如H2S,HS−,S2−,
,S0)作为反硝化的电子供体。基于硫化物、硫和硫代硫酸盐的反硝化反应如下(等式(8)~(10))。使用
由于电子供体可能实现比其他还原硫化合物更高的反硝化速率,但它会导致更高的硫酸盐产率 [9] [41]。
(8)
(9)
(10)
化学合成的S0 (S0-chem)已广泛用于含硫脱氮,但其低水溶性限制了传质速率。因此,一些研究人员将重点放在使用生物源S0 (S0 bio),这是工业废物流或天然气(例如金属精炼厂的废水和厌氧消化产生的沼气)脱硫的产物。Zhang等人 [42] 测试了S0 bio作为硫基反硝化的电子供体,并获得了比S0 chem高1.7倍的反硝化速率。此外,与添加S0-chem的膜生物反应器相比,添加S0-bio的膜生物反应器具有更好的反硝化性能。
工业活动和废物厌氧消化产生的H2S在100 ppm时对人体健康有害,填充床缺氧生物滴滤器用于利用含
废水从气流中去除H2S,可能是一种同时去除H2S和
的有前景的技术。在完全自养条件下,入口
负荷率在0.07到0.31 g∙N∙m之间时,H2S去除效率最高(>99%)-3 d−1 (N/S摩尔比 = 1.2~1.7)。生物滴滤器与H2SO2氧化硝酸盐还原菌株Paracoccus MAL 1HM19 l的生物强化可以在高
负荷率下提高H2S去除率 [43]。
除填充床和流化床生物膜反应器外,近年来的研究认为,硫化物或硫代硫酸盐基反硝化污泥的颗粒化将是一种很有前景的应用,其对各种环境因素(如pH、DO和温度)具有更好的弹性 [44]。Yang等人 [45] 采用了以硫化物为电子供体的颗粒污泥自养反硝化反应器,该反应器连续运行600多天,具有良好的稳定性。
Fe0和FeII:当使用Fe0作为反硝化的电子供体时,生物和非生物反应都可能发生。厌氧Fe0腐蚀导致H2生成,因为Fe0在水中热力学不稳定(等式(11))。氢营养反硝化菌可以使用产生的H2去除硝酸盐。同时,非生物
与Fe0还原,其中最终产物主要由
而不是N2 (等式(12))。厌氧Fe0腐蚀和自养氢营养反硝化(等式(13))的组合比用Fe0还原非生物
更可行,因为N2作为最终产物比
更有利。然而,生物脱氮不可避免地会将
还原为
。需要采取策略来尽量减少
的产生。研究人员发现,Fe0浓度的降低可能会减少非生物
的产生。此外,用其他金属掺杂Fe0,例如(Pd\\Cu)/Fe0、Cu2O-Cu/Fe0和TiO2/Fe0,可以提高用Fe0还原非生物
的N2选择性 [46]。
(11)
(12)
(13)
除Fe0外,使用FeII作为电子供体的反硝化过程最近备受关注,其反应如下:
(14)
Ruby等人 [47] 首次观察到淡水沉积物中存在FeII氧化和硝酸盐还原。然而,在接下来的20年研究中,研究人员发现,大多数分离的FeII氧化反硝化菌是异养的,只能在有机碳存在的情况下生长。这使人们怀疑所谓的FeII氧化脱氮是一种酶催化的生物过程,还是FeII与活性氮中间产物(即
)的简单化学反应。研究表明,通过FeII的化学作用,可以将异养反硝化菌产生的
直接还原为N2或N2O。Meyer等人 [48] 通过分析N2O中的δ15N发现,在假单胞菌纯培养物中,化学FeII氧化反硝化占主导地位。
近年来,人们对铁基自养反硝化在废水处理中的应用进行了研究。然而,在这些研究中,硝酸盐去除率(0.07~0.33 g-N/L/d)相对较低。此外,长期运行后产生的三价铁可能会形成铁壳,导致反硝化活性下降。未来的研究需要采取措施来消除或避免铁锈。
FeS:硫化亚铁(FeS)、磁黄铁矿(Fe1−xS)和黄铁矿(FeS2)可以用作反硝化的电子供体,其中的反应由等式(15)和(16)描述。根据化学计量方程(等式(15)和(16)),与使用S0作为电子供体相比,产生的硫酸盐更少。
(15)
(16)
(17)
最近研究了基于铁硫化物的反硝化在地下水修复和废水处理中的应用。Mao等人 [49] 评估了基于黄铁矿的生物修复的可行性和耐用性,该生物修复在流动实验中实现了持续180天的完全硝酸盐去除。Li等人 [50] 报告了磁黄铁矿自养反硝化生物滤池的效率,其中95.9%的
可以用24 h的HRT去除。在Yang等人 [51] 的研究中,纳米结构磁黄铁矿自养反硝化生物滤池实现了更短的HRT (1.2 h)和更高的氮去除效率(99.6%)。此外,还研究了颗粒剂量、硫化铁预处理和操作温度对基于硫化铁的反硝化性能的影响。
然而,微生物如何利用固态电子供体硫化铁的机制仍然是一个悬而未决的问题。目前尚不清楚微生物是通过细胞外电子转移直接利用硫化铁,还是在利用之前转化为可溶形式。Zhao等人 [52] 认为,FeS2可能首先受到Fe3+的攻击,然后溶解到
,然后再被反硝化菌利用。Hosono等人 [53] 推断,反硝化菌可能只利用FeS2表面的元素硫(S0),而不是直接利用FeS2。Huang [54] 推测,微生物产生的电子梭首先诱导FeS2氧化为生物可用硫(例如S0),然后S0被硫氧化反硝化菌利用。
4. 不同电子供体的差异
用于
处理的反硝化电子供体的选择应基于对反硝化速率、效率以及环境影响的评估。本节总结了使用不同电子供体的反硝化速率(硝酸盐去除率)和效率。由于电子供体的类型和生物利用度、反应器配置、操作条件和进水特性的不同,脱氮速率表现出很大的差异。
4.1. 反硝化性能
通常,使用有机电子供体的异养反硝化比使用无机电子供体的自养反硝化具有更高的反硝化速率,因为异养反硝化菌通常比自养反硝化菌具有更高的比生长速率。电子供体的生物利用度对反硝化性能有很大影响。反硝化菌可以直接使用低分子量液体有机物。此外,液相电子供体具有高接触面积,因此具有滞后期短和快速脱氮的优点。近年来,利用高分子量电子供体的固相异养反硝化受到了广泛关注。使用合成的可生物降解聚合物作为电子给体的异养反硝化可以获得与使用传统液相有机物类似的硝酸盐去除率。在大多数报告的研究中,使用合成可生物降解聚合物比使用天然木质纤维材料具有更高的脱氮率。在填充床生物反应器中,当使用PCL或PBS作为电子供体时,
去除率范围为1.23~3.80g N/L∙d当使用木片或麦秆时,其范围为0.01~0.06 g N/L∙d。然而,一些研究人员提出,天然木质纤维材料可以溶解促进反应的微量元素和常量元素 [55]。
就自养反硝化而言,与其他自养反硝化工艺相比,基于H2和硫的反硝化具有较高的硝酸盐去除率。在某些情况下,基于H2和硫的反硝化甚至比异养反硝化具有更高的硝酸盐去除率。对于基于H2的反硝化,由于H2的低水溶性是反硝化速率的主要限制因素,因此使用透气膜(如中空纤维膜)可以通过促进H2溶解来提高反硝化速率。在H2基中空纤维膜生物膜反应器中,硝酸盐去除率范围为0.8~2.9 g N/L∙d、对于硫基反硝化,据报道,
的硝酸盐去除率明显高于S2−和S0。由于其高溶解度和生物利用度,
是所有还原硫化合物中最有效的电子供体。在基于
的上流式厌氧污泥反应器中,硝酸盐去除率可达到6.72 g N/L∙d [56]。
有一些实验室规模的自养反硝化试验使用Fe2+或硫化铁作为电子供体。然而,在基于Fe2+和硫化铁的反硝化反应器中观察到的最大反硝化速率分别不超过0.33和0.38 g N/L∙d。相对较低的反硝化速率限制了它们用于自养反硝化。
表1总结了使用不同电子供体的反硝化效率(硝酸盐去除率)和速率。由于电子供体的类型和生物利用度、反应器配置、操作条件和进水特性的不同,反硝化速率的范围很宽。

Table 1. Difference in denitrification performance caused by electron donors
表1. 电子供体引起的反硝化性能差异
4.2. 环境影响
二次有机污染的风险是传统异养反硝化的主要缺点。甲醇毒性很高,如果从过程中释放出来,可能会对环境造成有害影响。相比之下,固体有机电子供体对环境的影响较小。H2是最清洁的电子供体,在基于H2的反硝化过程中不会产生任何不需要的化合物。因此,它是饮用水处理的最佳选择。对于硫基脱氮,
的产生是主要的缺点。美国环保局制定的饮用水中
浓度的水质标准低于250 mg/L。因此,应小心控制含硫化合物的剂量。表2总结了用于生物脱氮的各种电子供体的优缺点。

Table 2. Advantages and disadvantages of electron donors in denitrification process
表2. 反硝化过程中不同电子供体的优缺点。
5. 总结以及未来期望
生物脱氮是废水中去除
最经济的方法,利用有机碳物质作为电子供体的异养反硝化已被证明在用于大规模废水处理是高效的。然而,在处理低碳氮比废水时,额外的有机碳源可能会增加二次污染风险。因此,利用无机电子供体的自养反硝化已发展成为处理缺乏有机碳废水的方法。H2是最清洁的电子供体,氢营养反硝化可能是最佳选择,然而,为了提高
去除效率和安全性,应研究自生氢营养过程的操作参数,如氢气和CO2流速、pH值、温度以及营养盐浓度。此外,使用还原硫化合物(例如硫化物、元素硫和硫代硫酸盐)作为电子供体的自养反硝化是一种经济高效的工艺,产生的
的控制是硫基脱氮的主要关注点。未来的研究可能集中在以下几个方面:与传统的液相异养反硝化相比,固相异养反硝化具有许多优势。然而,固相异养反硝化在大规模应用中的可行性和成本分析还需要进一步研究,未来应开发更具成本效益的可生物降解聚合物。异养反硝化和硫基自养反硝化的结合已成为一种新的
处理方法,与单一异养或硫基自养工艺相比,可以降低成本和抑制
的产生,探索异养/自养反硝化的最佳配置和不同的有机/无机源组合可能是未来的研究方向。
致谢
本项目受浙江树人学院引进人才启动项目资助项目。
NOTES
*通讯作者。