1. 引言
抗氧化多肽是一种有抗氧化作用的生物活性肽,它包含2~20种氨基酸,有时甚至多于20种氨基酸。抗氧化多肽在蛋白的序列中并不活跃,通过水解释放出来才有活性 [1] 。抗氧化肽的作用机制包括清除自由基、调节肠道菌群、保护细胞等,因此适量摄入具有抗氧化性的食物,能够让人体内的自由基保持平衡,增强人体的免疫功能,从而保持人体健康 [2] [3] 。抗氧化肽的来源有植物性来源和动物性来源,植物性来源有绿豆 [4] 、燕麦 [5] 、鹰嘴豆 [6] 、玉米 [7] 和杏鲍菇 [8] 等,动物性来源有鲭鱼 [9] 、扇贝 [10] 、扁舵鲣鱼 [11] 、鸽血 [12] 和鸡肉 [13] 等。海洋生物作为抗氧化肽的理想来源,海洋生物抗氧化肽的研究在医药、化妆品、保健品行业具有广泛的应用 [14] 。
广东是对虾养殖第一大省,而湛江对虾的养殖规模居广东首位。湛江对虾产业依靠其独特的海洋环境和地理位置,已发展成为一条成熟的产业链 [15] 。对虾在加工过程中会产生占总质量30%~40%的下脚料,这些下脚料主要包括虾头、虾壳等 [16] [17] 。对虾加工下脚料的主要成分为甲壳素、蛋白质和脂肪,同时其含有的氨基酸和矿物质种类丰富 [18] 。对虾头的综合利用,目前主要有乙酰壳聚糖、甲壳质、虾黄酱、虾钙粉、虾脑油、虾黄素、几丁质酶和透明质酸酶等相关产品上市 [19] ,这些产品的开发不仅提高了虾头的利用率,也为相关行业提供了更多的资源选择。据李等最新治疗效果分析表明,笔者医院对收治的17例面部注射透明质酸导致血管栓塞的患者采取综合治疗,包括局部注射透明质酸酶、按摩、扩张血管、药物湿敷、清创换药及全身抗感染治疗等,结果为17例患者中,14例患者完全康复,2例患者遗留色素沉着,1例患者遗留瘢痕 [20] 。壳聚糖在重金属治理领域有着广泛应用,例如黄吉等研究发现,壳聚糖和甲壳素主要通过混凝、沉淀、絮凝、吸附、浮选、过滤、膜滤等方式去除水中的污染物,特别地,氨基和羟基含量高的壳聚糖可作为吸附剂用于净化含重金属的废水,对有价金属的回收和废水处理具有重要的应用价值和市场前景 [21] 。
但上述利用虾头所开发的产品并未合理利用蛋白质,浪费了宝贵的蛋白质资源。因此,本研究以湛江对虾下脚料作为原料,蛋白酶水解、单因素试验和三响应面试验优化设计来制备抗氧化肽,并鉴定湛江对虾下脚料水解产物的抗氧化活性,为湛江对虾下脚料抗氧化肽的研究提供新的思路。
2. 材料与方法
2.1. 试剂与设备
湛江对虾加工下脚料(湛江国联水产开发股份有限公司);木瓜蛋白酶(980 u/mg,北京鸿润宝顺科技有限公司);菠萝蛋白酶(800 u/mg,北京鸿润宝顺科技有限公司);中性蛋白酶(200 u/mg,北京鸿润宝顺科技有限公司);碱性蛋白酶(200 u/mg,北京鸿润宝顺科技有限公司);胰蛋白酶(250 u/mg,北京鸿润宝顺科技有限公司);氢氧化钠(分析纯,广东光华科技股份有限公司);30%过氧化氢(分析纯,国药集团化学试剂有限公司);盐酸(分析纯,廉江市爱廉化试剂有限公司);三氯乙酸(分析纯,广东光华科技股份有限公司);五水硫酸铜(分析纯,广东光华科技股份有限公司);无水乙醇(分析纯,广东光华科技股份有限公司)其他试剂均为国产分析纯。
电子分析天平AUY120岛津仪器有限公司;粉碎机MJ-BL25B3美的生活电器制造有限公司;数显恒温水浴锅HH-2常州荣华仪器制造有限公司;精密pH计PHSJ-4F上海仪电科学仪器股份有限公司;电热鼓风干燥箱DHG-9035A东方化玻科技有限公司;紫外可见分光光度计TU-1810北京普析通用仪器有限责任公司;台式高速冷冻离心机H3-20KR湖南可成仪器设备有限公司;旋涡混合器GL-88B其林贝尔仪器制造有限公司。
2.2. 试验方法
2.2.1. 原料预处理
使用粉碎机将湛江对虾下脚料粉碎至无明显块状,装袋置于−20℃冰箱中保存备用。
2.2.2. 湛江对虾下脚料的酶解工艺
将虾糜与蒸馏水按照1:9的料液比混匀,将其调节至适合的pH值后,再添加适量的蛋白酶,置于已调节至适宜温度的恒温水浴锅中酶解4 h,酶解结束后置于沸水浴中灭酶15 min,冷却后以10000 r/min离心10 min,取上清液备用 [22] 。
2.2.3. 蛋白酶的筛选
采用2.2.2的酶解工艺,按表1中各蛋白酶的最适条件调整酶解条件,对虾糜进行酶解,离心后取上清液,利用双缩脲法测定其多肽含量,并将其配制成系列浓度的样品,同时配制一系列相同浓度的L-抗坏血酸溶液作为阳性对照,以DPPH自由基清除率、羟自由基清除率和还原力为评价指标,从五种蛋白酶中筛选出最佳蛋白酶,并验证湛江对虾下脚料水解产物具有抗氧化活性。

Table 1. Conditions for the enzymatic reaction of various protease
表1. 各蛋白酶的酶解反应条件
2.2.4. 多肽含量的测定
取5 mL酶解液于烧杯中,再用5%三氯乙酸定容至50 mL容量瓶中,混匀后静置10 min。取2 mL样品溶液加入4 mL双缩脲试剂混匀,静置30 min后取上清液在540 nm下测定吸光值,对照标准曲线计算样品溶液中的多肽浓度C (mg/mL)。
用5%三氯乙酸(TCA)溶液配制一系列浓度的谷胱甘肽(GSH)标准溶液,取2 mL GSH溶液加入4 mL双缩脲试剂,其它步骤同上,以GSH浓度为横坐标,OD540为纵坐标绘制标准曲线 [23] (图1)。
2.2.5. DPPH自由基清除率的测定
取2 mL酶解液与2 mL DPPH溶液(0.2 mmol/L)于试管中,混匀,在室温下避光反应30 min,于517 nm处测吸光度,作样品组;用等体积的无水乙醇替换DPPH溶液,其余步骤同上,作对照组;用等体积的无水乙醇替换酶解液,其余步骤同上,作空白组 [23] 。DPPH自由基清除率根据下式计算:
式中Ai、Aj、A0分别为样品组、对照组、空白组吸光度。
2.2.6. 羟自由基清除率的测定
取1 mL酶解液、5 mL FeSO4溶液(1 mmol/L)及5 mL H2O2溶液(3 mmol/L)于比色管中,充分混匀后再加入14 mL水杨酸–乙醇溶液(3 mmol/L),置于37℃的恒温水浴锅中,反应30 min。于510 nm处测吸光度,作样品组;用等体积的蒸馏水替换H2O2溶液,其余步骤同上,作对照组;用等体积的蒸馏水替换酶解液,其余步骤同上,作空白组 [23] 。羟自由基清除率根据下式计算:
式中As、Ab、A0分别为样品组、对照组、空白组吸光度。
2.2.7. 还原力的测定
样品组:取2 mL酶解液,2 mL磷酸盐缓冲液(0.2 mol/L, pH 6.6)与2 mL铁氰化钾溶液(1%)于试管中,振荡混匀,置于50℃恒温水浴锅中保温20 min,然后向混合液加入2 mL三氯乙酸溶液(10%),混匀后静置10 min,取2 mL上清液置于另一试管中,再加入2 mL蒸馏水和1 mL三氯化铁溶液(0.1%),混匀,放置10 min后,于700 nm处测定其吸光度;空白组:用等体积的蒸馏水替换酶解液,其余与样品组相同 [24] 。还原力根据下式计算:
式中As、A0分别为样品组、空白组吸光度。
2.3. 单因素试验设计
选择2.2.3筛选出的最佳蛋白酶进行酶解。
2.3.1. 温度对湛江对虾下脚料多肽抗氧化活性的影响
料液比1:9,加酶量6000 U/g,pH 7,分别在温度为35℃、40℃、45℃、50℃、55℃下酶解4 h,测定抗氧化活性。
2.3.2. pH对湛江对虾下脚料多肽抗氧化活性的影响
料液比1:9,加酶量6000 U/g,温度45℃,分别在pH为6、6.5、7、7.5、8下酶解4 h,测定抗氧化活性。
2.3.3. 添加酶量对湛江对虾下脚料多肽抗氧化活性的影响
料液比1:9,温度45℃,pH 7.5,分别加入8000、9000、10,000、11,000、12,000 U/g蛋白酶酶解4 h,测定抗氧化活性。
2.4. 响应面试验设计
基于单因素试验结果,以各因素3个最佳条件作为自变量,酶解液DPPH自由基清除率、羟自由基清除率和还原力为响应值,进行响应面试验。运用Box-Behnken设计3因素3水平试验(表2),确定湛江对虾下脚料抗氧化肽最佳酶解工艺。

Table 2. Code in response surface design
表2. 响应面设计编码表
3. 结果与分析
3.1. 蛋白酶的筛选及鉴定湛江对虾下脚料多肽的抗氧化活性
3.1.1. 不同蛋白酶对DPPH自由基清除率的影响
由图2知,浓度增大,DPPH自由基清除率也随之增大,表明湛江对虾下脚料水解产物与L-抗坏血酸具有DPPH自由基清除能力。不同蛋白酶酶解得到的水解产物的DPPH自由基清除率由高到低依次为:中性蛋白酶 > 木瓜蛋白酶 > 碱性蛋白酶 > 菠萝蛋白酶 > 胰蛋白酶,但均弱于L-抗坏血酸。当质量浓度为25 mg/mL时,由中性蛋白酶酶解得到的水解产物的DPPH自由基清除率为64.63%,最为接近对照品L-抗坏血酸的DPPH自由基清除率91.81%,表明由中性蛋白酶酶解得到的水解产物相较于其它蛋白酶酶解得到的水解产物具有更好的DPPH自由基清除能力。

Figure 2. Effect of different protease on DPPH free radical scavenging
图2. 不同蛋白酶对DPPH自由基清除率的影响
3.1.2. 不同蛋白酶对羟自由基清除率的影响
由图3知,浓度增大,羟自由基清除率也随之增大,表明湛江对虾下脚料水解产物与L-抗坏血酸具有羟自由基清除能力。不同蛋白酶酶解得到的水解产物的羟自由基清除率由高到低依次为:胰蛋白酶 > 菠萝蛋白酶 > 碱性蛋白酶 > 中性蛋白酶 > 木瓜蛋白酶,但均弱于L-抗坏血酸。当质量浓度为25 mg/mL时,由胰蛋白酶酶解得到的水解产物的羟自由基清除率为84.38%,最为接近对照品L-抗坏血酸的羟自由基清除率85.16%,说明由胰蛋白酶酶解得到的水解产物相较于其它蛋白酶酶解得到的水解产物具有更好的羟自由基清除能力。

Figure 3. Effect of different protease on hydroxyl radical scavenging
图3. 不同蛋白酶对羟自由基清除率的影响
3.1.3. 不同蛋白酶对还原力的影响
由图4知,浓度增大,还原力也随之增强,表明湛江对虾下脚料水解产物与L-抗坏血酸具有还原力。不同蛋白酶酶解得到的水解产物的还原力由高到低依次为:中性蛋白酶 > 菠萝蛋白酶 > 碱性蛋白酶 > 胰蛋白酶 > 木瓜蛋白酶,但均弱于L-抗坏血酸。当质量浓度为25 mg/mL时,由中性蛋白酶酶解得到的水解产物的还原力吸光值为1.627,最为接近对照品L-抗坏血酸的还原力吸光值2.063,说明由中性蛋白酶酶解得到的水解产物相较于其它蛋白酶酶解得到的水解产物具有更好的还原力。
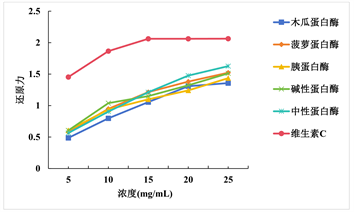
Figure 4. Effect of different protease on reducing power
图4. 不同蛋白酶对还原力的影响
由上述可知,由中性蛋白酶酶解得到的水解产物对DPPH自由基的清除作用和还原力最强,而由胰蛋白酶酶解得到的水解产物对羟自由基的清除作用最强。综合各蛋白酶酶解得到的水解产物对抗氧化活性的影响的结果,最终选定中性蛋白酶作为本次试验用酶。
3.2. 单因素试验结果
3.2.1. 温度对抗氧化活性的影响
由图5知,DPPH自由基清除率、羟自由基清除率及还原力三者均随温度的上升呈先升高后降低的趋势,在45℃时达到最高值。这是因为在某一温度范围内,当温度上升时,蛋白酶的活力会随之上升,酶解所得多肽的含量也随之上升,但温度再继续上升就会导致蛋白酶失活,所以当温度超过45℃时,抗氧化活性下降。通过显著性分析知,温度为45℃时对抗氧化活性效果显著(P < 0.05)。综上所述,确定45℃为蛋白酶水解的最适温度,因此选择45℃为试验温度。
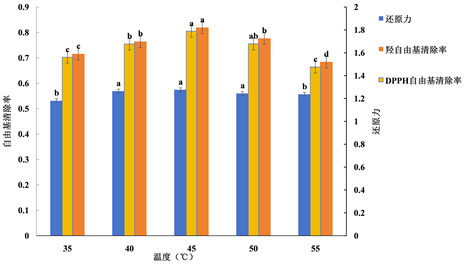 注:不同处理间没有相同的小写字母表示差异显著(P < 0.05)。
注:不同处理间没有相同的小写字母表示差异显著(P < 0.05)。
Figure 5. Effect of temperature on antioxidant activity
图5. 温度对抗氧化活性的影响
3.2.2. pH对抗氧化活性的影响
由图6知,DPPH自由基清除率、羟自由基清除率及还原力三者均随着pH的增大呈先升高后下降的趋势,在7.5时达最高值。这是因为pH值太高或者太低,都会对蛋白酶的结构产生影响,进而影响到酶解的效果。通过显著性分析知,pH为7.5时对抗氧化活性效果显著(P < 0.05)。综上所述,确定7.5为蛋白酶水解的最适pH,因此选择7.5为试验pH。
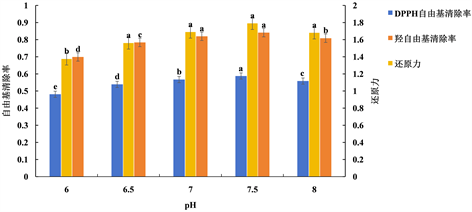 注:不同处理间没有相同的小写字母表示差异显著(P < 0.05)。
注:不同处理间没有相同的小写字母表示差异显著(P < 0.05)。
Figure 6. Effect of pH on antioxidant activity
图6. pH对抗氧化活性的影响
3.2.3. 加酶量对抗氧化活性的影响
由图7知,DPPH自由基清除率、羟自由基清除率及还原力三者均随加酶量的增加呈先升高后趋于平缓的趋势。开始时升高是因为酶的用量越多,与底物结合的越多,能被酶解的蛋白质的量就越多;后面变得平缓,是因为底物与蛋白酶的接触位点已达到饱和,所以后面即使加入再多的酶,多肽的含量也不会增加。通过显著性分析知,加酶量为10,000、11,000、12,000 U/g时对抗氧化活性效果显著(P < 0.05),但考虑成本问题,选择10,000 U/g作为最适加酶量。综上所述,确定10,000 U/g为蛋白酶水解的最适加酶量,因此选择10,000 U/g为试验加酶量。
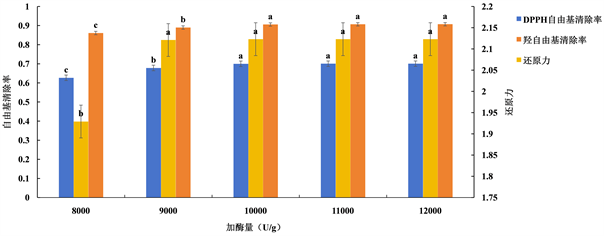 注:不同处理间没有相同的小写字母表示差异显著(P < 0.05)。
注:不同处理间没有相同的小写字母表示差异显著(P < 0.05)。
Figure 7. Effect of enzyme dosage on antioxidant activity
图7. 加酶量对抗氧化活性的影响
3.3. 响应面试验设计结果
3.3.1. 响应面试验设计结果
根据单因素试验结果,选择温度45℃,pH 7.5,加酶量10,000 U/g为优化因素,以DPPH自由基清除率、羟自由基清除率和还原力为响应值,进行响应面试验。运用Box-Behnken设计3因素3水平试验,确定湛江对虾下脚料抗氧化肽最佳酶解工艺,结果如表3所示。

Table 3. Design and results of response surface methodology
表3. 响应面试验设计方案及试验结果
将表3中的试验结果利用Design-Expert 8.0.6软件模拟,得出回归模型方程:
3.3.2. 响应面试验结果的方差分析
由表4、表5和表6知,三个模型的P值均小于0.05,说明三个模型均显著。以DPPH自由基清除

Table 4. Model regression equation variance analysis (DPPH free radical clearance is response value)
表4. 模型回归方程方差分析(DPPH自由基清除率为响应值)
注:P < 0.05,表明差异具备显著性,用*表示;P < 0.01,表明差异极显著,用**表示。

Table 5. Model regression equation variance analysis (hydroxyl radical clearance is response value)
表5. 模型回归方程方差分析(羟自由基清除率为响应值)
注:P < 0.05,表明差异具备显著性,用*表示;P < 0.01,表明差异极显著,用**表示。

Table 6. Model regression equation variance analysis (reducing force is response value)
表6. 模型回归方程方差分析(还原力为响应值)
注:P < 0.05,表明差异具备显著性,用*表示;P < 0.01,表明差异极显著,用**表示。
率和羟自由基清除率为响应值的失拟项误差均不显著,说明回归模型拟合度较高,可靠性强;而以还原力为响应值的模型失拟项显著,表明数据中有少量的差异点。三个模型的相关系数R2分别为0.9666,0.9660,0.9934,均大于0.95,说明相关度好。各因素对DPPH自由基清除率和羟自由基清除率的响应均为:C极显著,A2极显著,B2极显著,对还原力的响应为C极显著,A2极显著,B2极显著,C2极显著。由显著性及F值可知,各因素对DPPH自由基清除率的响应值影响的顺序为:加酶量 > 温度 > pH,对羟自由基清除率和还原力的响应值影响的顺序为:加酶量 > pH > 温度。
3.3.3. 响应面分析
三维曲线图曲线的弧度反映了因素对响应值的影响程度,曲线弧度越大表示该因素对响应值的影响越大 [25] 。响应面等高线图反映了各因素对响应值的影响程度,坡面越陡表示该因素对响应值影响越显著 [26] 。由图8知,以DPPH自由基清除率为响应值时温度与pH两因素间的交互效应响应面坡面最为陡峭,三维曲面图的弧度最大,与表4中的回归分析结果相符。
3.3.4. 工艺条件的优化和验证
综合上述响应面试验结果,运用Design-Expert 8.0.6软件得到酶法制备湛江对虾下脚料抗氧化肽的最佳工艺为温度44.88℃、pH 7.48、加酶量10999.92 U/g,在此条件下所得的酶解液的DPPH自由基清除率为72.3061%、羟自由基清除率为92.355%、还原力吸光值为2.36193。为方便实际操作稍作调整:温度45℃、pH 7.5、加酶量11,000 U/g,在此条件下所得的酶解液的DPPH自由基清除率为71.47%、羟自由基清除率为91.54%、还原力吸光值为2.16。由上述可知实际值与预测值无显著差异,模型可靠。
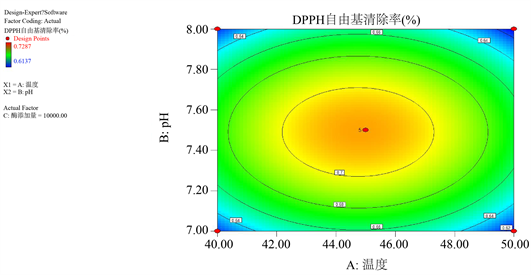
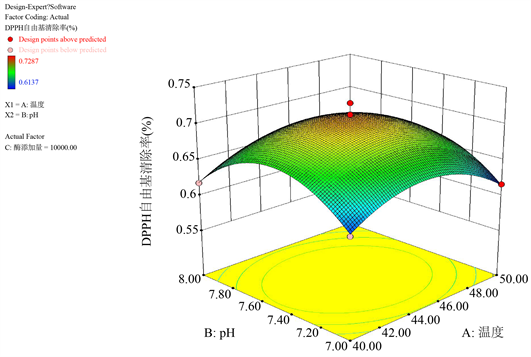
Figure 8. 3-D surface and contour map of enzymolysis temperature and pH on DPPH free radical clearance
图8. 温度与pH对DPPH自由基清除率交互影响的三维曲面和等高线图
4. 结论
本试验在筛酶的基础上,验证了湛江对虾下脚料水解产物具有抗氧化性,通过单因素试验探究温度、pH、加酶量对DPPH自由基清除率、羟自由基清除率和还原力的影响,经响应面法优化确定酶解最佳工艺为温度45℃、pH 7.5、加酶量11,000 U/g,所得的酶解液的DPPH自由基清除率为71.47%、羟自由基清除率为91.54%、还原力吸光值为2.16。本研究与刘、符等 [27] [28] 的研究成果相比,实现了对虾下脚料中抗氧化物质的高效提取,有效保留了对虾下脚料中的抗疲劳、抗氧化多肽成分,且其加工方式也更为环保,为对虾下脚料的高值化应用提供了理论基础和数据支撑。
基金项目
2021年度湛江市海洋青年人才创新项目(2021E05022)。
NOTES
*通讯作者。