1. 引言
在各种解决水资源短缺的方法中,海水淡化因不受气候和时空限制已成为解决沿海地区淡水供给的可持续发展的重要方式 [1] [2] ,在部分海岛地区甚至是唯一有效的途径。截至2021年底,全国现有海水淡化工程144个,工程规模1,856,433吨/日 [3] 。海水淡化是从天然海水中分离淡水的过程 [4] [5] ,在此过程中,只有不到50%的海水变为淡水,其余海水以浓海水的形式排出。随着海水淡化产能的快速增加,浓海水排放对海洋生态环境的影响引起了人们的注意 [6] [7] [8] [9] [10] ,这也是海水淡化产业发展过程中需要解决的问题,有必要科学认识海水淡化浓海水排海对海洋生态环境可能产生的影响。
我国海水淡化产业尚处于发展初期,海水淡化规模以及浓海水排放量较低,虽未见海水淡化浓海水对海洋生态环境有明显影响的报道,但随着海水淡化规模的不断增加,这一问题将会逐渐突出,浓海水的温度、盐度和溶解化学物质的含量高于天然海水,其大量排放可以改变接受水体的环境参数,破坏海洋生物的丰度、多样性、代谢速率和生理过程 [11] [12] ,改变海洋生物群落结构,可能对海洋生态环境产生不可忽视的影响。目前国内外关于海水淡化浓海水生态影响的研究主要集中在排放口附近的生态监测和实验室研究等方面 [13] [14] [15] [16] [17] ,尚无海水淡化浓海水排海生态环境影响的全面和长期的调查研究。浓海水排放对海洋生态环境的影响与海水淡化规模、技术工艺特性、排放方式和受纳海域生态系统类型等因素有关,其对海洋生态系统的环境影响是一个长期的、累积的过程。
本研究通过2021年对青岛百发海水淡化浓海水入海排放海域海水水质及海洋生态环境的调查与监测,采用改进的内梅罗指数和生物多样性指数对海水淡化浓海水排水口附近海域海水水质和浮游动植物群落结构进行分析和评价,以期为海水淡化浓海水排海生态环境的影响评价提供基础数据资料,为科学认识海水淡化浓海水排海对海洋生态环境的影响提供技术支撑。
2. 材料与方法
2.1. 采样时间与站位布设
青岛百发反渗透海水淡化工程取水量为27万吨/日,排出浓海水量为17万吨/日,浓海水经地下管网排至楼山河河道感潮河段内,排水口位于胶州湾北部楼山河入海口上游南岸50 m处。青岛百发海水淡化工程排放浓海水水质特征如表1所示。

Table 1. Quality of brine discharged from Qingdao Baifa Seawater Desalination Plant
表1. 青岛百发海水淡化厂排放浓海水水质
从表1可知,海水淡化浓海水的盐度是原海水的1.70倍,pH值比原海水略低,CODMn和DIP (活性磷酸盐)与原海水接近。浓海水的DIN (无机氮)是原海水的1.64倍,与盐度升高的倍数相当,推测是由于海水淡化过程对无机氮的浓缩所导致。浓海水的重金属含量相比原海水略有增加,Cu、Pb、Ni、Cr、Cd的浓度分别为原海水的1.26、1.65、1.50、1.09、1.41倍。海水中重金属在淡化预处理过程中被部分去除,剩余的重金属被反渗透膜截留而保留在浓水中。总体来看,淡化厂排放的浓海水中重金属浓度很低,Cu、Pb、Ni、Cr均低于《海水水质标准》(GB 3097-1997)一类海水限值。
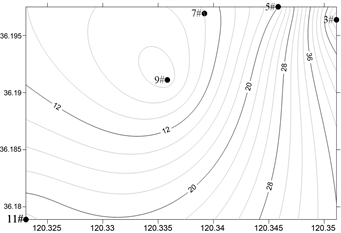
为监测海水淡化排水对附近海域海洋环境的影响,以楼山河入海口为扇形圆心,综合考虑海水淡化浓海水扩散方向及波浪潮流等水文情势,设置三个断面,共布设11个监测站位,其中生态调查站位5个(3#,5#,7#,9#,11#),于2021年5月(春季)、7月(夏季)、9月(秋季)和11月(冬季)进行了4次海水淡化浓海水生态环境影响调查监测。站位布置示意如图1所示,使用GPS定位设备确保调查船只进入预定站位。

Figure 1. Distribution map of survey and monitoring stations for brine discharge from seawater desalination
图1. 海水淡化浓海水排放调查监测站位分布图
2.2. 样品采集与分析
通过5 L卡盖式采水器采集海水样品,海水样品采集、保存、预处理和分析检测严格按照《海洋调查规范》(GB12763.1-2007) [18] 和《海洋监测规范》(GB17378.4-2007) [19] 执行。调查海域水深在2.0~5.5 m,所有站位均采集表层样品。采用YSI便携式多参数水质分析仪现场测定温度、盐度、pH与溶解氧(DO),采用碱性高锰酸钾法、次溴酸盐氧化法,重氮偶氮法、锌镉还原法,抗坏血酸还原磷钼蓝法,分别测定化学需氧量(CODMn)、铵盐(
)、亚硝酸盐(
)、硝酸盐(
)、活性磷酸盐(DIP)浓度,采用石墨炉原子吸收分光光度法测定Cu、Pb、Cr、Ni、Cd的浓度,无机氮(DIN)为
、
和
三者总和。
浮游生物样品采集和分析依据《海洋监测规范》(GB17378.7-2007) [20] 进行。使用浅水III型浮游生物网(网口直径37 cm,网口面积0.1 m2,网长1.4 m,筛绢孔径0.077 mm)和浅水II型浮游生物网(网口直径50 cm,网口面积0.08 m2,网长1.4 m,筛绢孔径0.160 mm)从底至表垂直拖曳分别采集浮游植物和浮游动物样品,将样品收集至样品瓶中并立即用5%的甲醛溶液固定,带回实验室进行分析。浮游生物样品分析按个体计数法在显微镜下鉴定到种,对少数无法确定的种类鉴定到属。统计各站位浮游生物的物种组成,并计算其密度和生物量。
2.3. 评价方法和评价标准
2.3.1. 海水水质评价
采用标准指数法和改进内梅罗污染指数法 [21] 分别评价海水水质单项和综合污染程度。根据山东省海洋功能区划,调查海域执行《海水水质标准》(GB3097-1997) [22] 中的第四类海水水质标准。
1) 标准指数法
① 一般水质因子
(1)
式中,Pi——i污染物的污染指数;Mi——i污染物的算术平均值;Si——i污染物的标准值。
② pH值的标准指数
,当
时(2)
,当
时 (3)
式中:Pi——第i站位pH的污染指数;pHi——第i站位pH测量值;pHsu——pH的标准上限;pHsd——pH的标准下限。
③ DO的标准指数
,当
(4)
,当
(5)
(6)
式中:SDO,j——DO的标准指数;
DOf——某水温、气压条件下的饱和溶解氧浓度,mg/L;
T——水温,℃;
DOj——溶解氧实测值,mg/L;
DOs——溶解氧的评价标准限值,mg/L。
2) 改进的内梅罗污染指数法
因内梅罗指数未充分考虑各个评价因子的重要性,选取改进的内梅罗指数法进行评价。内梅罗污染指数(I)是衡量某个海域多种污染物综合污染程度的指标,其数学表达式为:
(7)
(8)
(9)
(10)
式中,I为海域水环境综合污染指数,Wi、Ri分别为评价指标的权重值和相关性比值,C0max为参与评价指标中标准值的最大者,C0i为第i项评价因子标准值,P′为修正后最大污染指数,Pimax为Pi的最大值,Pw为权重最大因子的污染指数,Piave为所有评价因子污染指数的平均值。
根据海域水环境综合污染指数与海水水质标准等级对应关系对海域综合污染程度进行等级划分(表2)。

Table 2. Correspondence between comprehensive pollution index and pollution degree of water environment in sea area
表2. 海域水环境综合污染指数与污染程度对应关系
2.3.2. 生态评价方法
根据每立方米水体中的个体数计算浮游生物丰度(ind./m3),生物量(mg/m3)为每立方米水体中浮游动物某种类固定样品的湿重。
浮游生物的优势种根据每个种类的优势度值(Y)来确定,以Y ≥ 0.02的种类作为优势种,采用香农–韦弗(Shannon-Weaver)多样性指数(H')、Pielou均匀度指数(J)和Margalef种类丰富度指数表征浮游生物群落的多样性。
浮游生物的丰度以每m3水体中的个体数(ind/m3)表示。优势种类根据每个种类的优势度(Y)来确定,Y ≥ 0.02的种类认定为优势种。
采用浮游生物优势度(Y)、Shannon-Weaver多样性指数(H')、Pielou均匀度指数(J)和Margalef丰富度指数(d)进行浮游生物群落生物多样性 [23] [24] [25] 分析,计算公示如下:
(11)
(12)
(13)
(14)
式中Pi为第i种的个体数(ni)与总个体数(N)的比值(ni/N);S为样品中的种类数量;fi为第i种浮游生物在调查站位出现的频率,Y为某种类的优势度,H'为Shannon-Weaver多样性指数,J为均匀度指数,d为Margalef丰富度指数。根据各站位浮游生物的种类组成、生物量及丰度,计算生物多样性、均匀度和丰富度指数,评价海水淡化浓海水排水海域生态环境质量现状。
3. 结果与分析
3.1. 海水水质调查监测结果与评价
3.1.1. 水质监测结果
2021年4个季度青岛百发浓海水调查海域海水水质监测结果如图2所示。
海水温度、pH值、DO和CODMn的监测结果如图2(a)所示。海水温度受季节变化影响较大,各调查站位平均水温春季(15.4℃)、冬季(12.1℃)低于夏季(25.1℃)、秋季(18.6℃)。因青岛百发海水淡化工程采用反渗透海水淡化工艺,产生浓海水的温度稍高于环境温度,但经过放流管排海后基本与环境海水温度相同。调查海域海水pH值变化范围在7.7~8.3之间,夏季海水pH值稍高,但变化不大,所有调查站位pH值均符合第四类海水水质标准的要求。各站位溶解氧平均浓度冬季(8.5 mg/L)和春季(8.5 mg/L)稍高,夏季(8.4 mg/L)次之,秋季(7.9 mg/L)最低。各站位平均高锰酸盐指数秋季较高(2.11 mg/L),夏季和冬季次之(皆为1.79 mg/L),春季较低(1.25 mg/L)。重金属Cu (1.92~4.94 μg/L)、Pb (1.45~2.01 μg/L)、Cr (3.39~5.93 μg/L)、Ni (0.88~1.44 μg/L)和Cd (2.01~3.12 μg/L)等重金属4个季度平均浓度较低(图2(b))。
春季各站位盐度普遍较高(图2(c)),高于全年平均盐度(29.78),夏季(29.92)和冬季(29.98)平均盐度接近,秋季平均盐度(28.54)稍低于其他季节。总的说来,各站位盐度相差不大,且盐度变化没有一定规律性,邻近楼山河入海口的1#、2#、3#、4#站位盐度没有明显高于扩散距离较远的8#、9#、10#、11#站位,秋冬季各站位盐度反而大致呈现出随扩散距离近低远高的趋势,说明浓海水排放没有造成排放口近岸海域盐度明显升高,百发海水淡化浓海水通过楼山河道排放,其在河道中已经经过稀释,盐度降低很多。
无机氮是氨氮、亚硝酸盐氮和硝酸盐氮的总和。青岛百发海水淡化浓海水排水海域各调查站位春季平均浓度(1.11 mg/L)较高(图2(d)),其它3个季节相差不多(0.77~0.88 mg/L),年均无机氮浓度为0.91 mg/L,邻近海水淡化浓海水排放口的站位无机氮浓度稍高于远离排放口的站位无机氮浓度,4个季度无机氮浓度均超过第四类海水水质标准的规定。活性磷酸盐(图2(e)),海水淡化浓海水排水海域各调查站位春季(0.09 mg/L)和夏季(0.06 mg/L)较高,秋季(0.04 mg/L和冬季(0.03 mg/L)较低,各站位活性磷酸盐浓度相差不大,春季和夏季各站位活性磷酸盐浓度全部超过第四类海水水质标准。青岛百发海水淡化浓海排水口处于楼山河入海口附近,毗邻污水处理厂,陆源污染源较多,无机氮浓度超标与海水淡化浓海水排放无明显关联。
3.1.2. 海水水质单因子污染指数评价
如表3所示,单因子质量指数评价结果表明,海水淡化浓海水排放海域主要污染因子为无机氮和活性磷酸盐,春季、夏季、秋季、冬季4个季度所有站位无机氮浓度均超过四类海水水质的标准值,活性磷酸盐春季和夏季超过四类海水标准,而秋季和冬季满足四类海水水质要求。全年来看,海水中主要污染指标为DIN和DIP,其年均单因子质量指数分别为1.86和1.23。除此之外,CODMn、DO和pH值均达到四类海水标准,重金属Cu、Pb、Cr、Ni、Cd浓度均较低,部分达到一类和二类海水标准。

Table 3. Single factor quality index of seawater quality in Qingdao Baifa seawater desalination brine discharge area
表3. 青岛百发海水淡化浓海排水海域海水水质单因子质量指数
3.1.3. 综合污染指数评价
内梅罗指数法作为一种综合污染指数法,常被用于污染海域海水水质的综合评价,但传统内梅罗指数法未充分考虑各个污染因子的相对重要性,过分突出了单因子污染指数最大因子对海水水质环境的影响,为客观严谨评价海水水质环境,区别对待同处一个质量级别的不同污染因子值,通过在改进公式中引入权重值因素体现污染危害性最大的污染因子对海水水质的影响。对海水水质来说,毒性金属和难降解有机污染物因其较低的标准值而具有较大的权重值。
通过对海水淡化浓海水排海海域主要海水水质指标的分析,选取无机氮(DIN)、活性磷酸盐(DIP)、高锰酸盐指数(CODMn)、铜(Cu)、铅(Pb)、铬(Cr)、镍(Ni)和镉(Cd)共8项指标作为水质评价因子进行改进内梅罗指数的计算,8个因子所对应的第四类海水水质标准列于表4中,其中镉的权重值最大为0.536,改进内梅罗指数的计算结果如表4所示。

Table 4. Weight calculation of each evaluation factor
表4. 各项评价因子权重计算
采用改进的内梅罗指数计算百发浓盐水排水海域海水综合质量指数,结果见图3,春季的改进内梅罗综合污染指数较高,最小值为0.539,出现在8#站位冬季调查,最大值为1.166,出现在11#站位春季调查。各调查站位年均内梅罗指数均在0.60~1.00之间,I值最大的4#站位为0.967,最小的8#站位为0.707,按表2的内梅罗污染指数与综合污染程度对应关系判断,属于较清洁海域,主要是无机氮超过四类海水标准,可见海水淡化浓盐水排放没有导致海域海水综合污染程度升高。
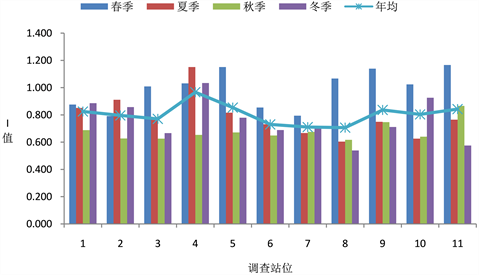
Figure 3. Comprehensive quality index of seawater in the survey sea area
图3. 调查海域海水综合质量指数
3.2. 生物生态监测与评价
3.2.1. 浮游植物群落结构调查与分析
1) 种类组成及优势种的变化分析
青岛百发浓海水排放海域全年4个航次共采集到浮游植物2大类49种,其中硅藻门44种,占总种数89.8%;甲藻门5种,占总种数10.2%。硅藻中的圆筛藻属最多有7种,角毛藻属次之有5种。
表5显示了4个季度海水淡化浓盐水排放海域浮游植物群落的优势种(Y ≥ 0.02)组成情况。春季有5种优势藻,以旋链角毛藻(Chaetoceros curvisetus)和角毛藻(Chaetoceros sp.)为主;夏季有6种优势藻,以菱形藻(Nitzschia spp.)为主,新月柱鞘藻(Cylindrotheca closterium)和柔弱伪菱形藻(Pseudo-nitzschia delicatissima)次之;秋季有5种优势藻,以浮动弯角藻(Eucampia zodiacus)和中肋骨条藻(Skeletonema costatum)为主,浮动弯角藻占细胞总丰度的51.17%;冬季有4种优势藻,以圆筛藻(Coscinodiscus sp.)为主,4个季度优势藻全部为硅藻。

Table 5. The dominant species of phytoplankton and seasonal changes in the survey sea
表5. 调查海域浮游植物优势种及季节变化
经上述分析,调查海域内不同季节的优势类群均为硅藻,虽然优势种有差异,但总体来看,主要为旋链角毛藻、浮动弯角藻、中肋骨条藻、圆筛藻和菱形藻等。优势种均为胶州湾内常见种,未发生明显变化。
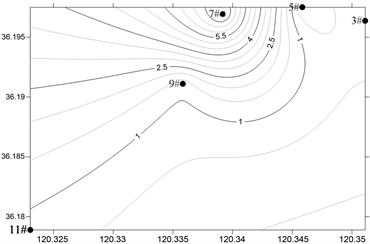
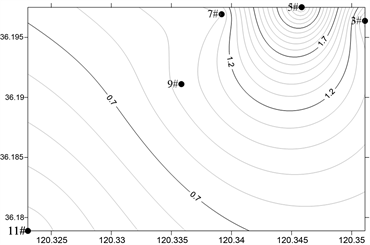
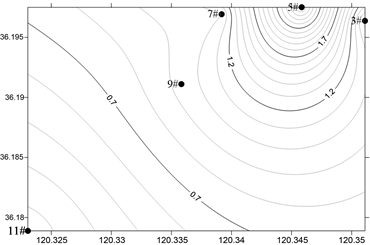
2) 浮游植物细胞丰度分布及季节变化
海水淡化浓海水排放海域全年浮游植物细胞丰度介于0.54~6496.00 × 104 cell/m3,平均值为1082.62 × 104 cell/m3,硅藻的丰度为21639.88 × 104 cell/m3,占细胞总丰度的99.94%,在数量上占绝对优势。图4显示了调查海域浮游植物丰度的季节变化。春季细胞丰度介于2.37~27.30 × 104 cell/m3,平均值11.49 × 104 cell/m3;夏季浮游植物细胞丰度介于0.54~77.95 × 104 cell/m3,平均值21.57 × 104 cell;秋季浮游植物细胞丰度介于2141.11~6496.00 × 104 cell/m3,平均值4261.22 × 104 cell;冬季浮游植物细胞丰度介于23.33~72.14 × 104 cell/m3,平均值36.21 × 104 cell,秋季浮游植物细胞丰度远远高于春、夏、冬3季。
 (a) 春季 (b) 夏季
(a) 春季 (b) 夏季
 (c) 秋季 (d) 冬季
(c) 秋季 (d) 冬季
Figure 4. Horizontal distribution of phytoplankton abundance in the survey sea (105 cells/m3)
图4. 调查海域浮游植物丰度的平面分布(105 cells/m3)
3) 浮游植物群落多样性指数的变化
浮游植物群落多样性指数是反映海域生态环境变化的重要指标,全年调查海域浮游植物多样性指数在0.983~3.418之间,平均值为2.138。图5(a)~(c)显示了浓海水调查海域浮游植物物种多样性指数、物种均匀度指数和物种丰富度指数的变化情况。
调查海域春季浮游植物群落多样性指数H'平均值为2.69,均匀度指数J平均值为0.71,物种丰富度指数d平均值为1.01,5#站位浮游植物丰度最大达2.73 × 105 cell/m3,9#站位发现15种浮游植物,物种丰富度最好。夏季浮游植物群落多样性指数H'平均值为2.49,均匀度指数J平均值为0.73,物种丰富度指数d平均值为0.90,3#站位发现17种浮游植物,物种多样性最好,7#站位浮游植物丰度最大达7.80 × 105 cell/m3;秋季浮游植物群落多样性指数H'平均值为1.83,均匀度指数J平均值为0.43,物种丰富度指数d平均值为1.03,各调查站位浮游植物丰度较高,均达107 cell/m3,高出其它季节2个数量级,各站位发现浮游植物种数均在17种以上,5#站位多达24种,浮动弯角藻和中肋骨条藻数量最多。冬季浮游植物群落多样性指数H'平均值为1.55,均匀度指数J平均值为0.53,物种丰富度指数d平均值为0.50,发现的浮游植物种类数较少。

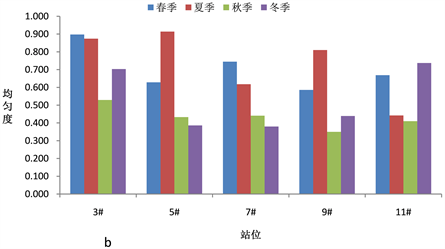
Figure 5. Phytoplankton diversity index in the survey sea
图5. 调查海域浮游植物多样性指数
3.2.2. 浮游动物群落结构调查与分析
1) 种类组成及优势种变化分析
调查海域4个季度调查共鉴定出浮游动物6大类30种,包括:节肢动物类15种,浮游幼虫10种,腔肠动物2种,原生动物1种,毛颚类1种,尾索动物1种。浮游动物种类数随季节变化显著,呈现春夏多,秋冬少的趋势,春季调查鉴定出浮游动物15种,夏季13种,秋季12种,冬季8种(表6),4个季度调查结果表明,在种类组成上,节肢动物、浮游幼虫占优势。

Table 6. Species composition of Zooplankton in different seasons
表6. 不同季节浮游动物种类组成
调查海域浮游动物优势种的丰度和数量存在季节性变化(表7),春季优势种有7种,主要优势种为桡足类六肢幼虫、多毛类幼虫和洪氏纺锤水蚤,夏季优势种计有4种,主要优势种为短角长腹剑水蚤、桡足类六肢幼虫和异体住囊虫,秋季优势种共有3种,主要优势种为异体住囊虫和肥胖三角溞,冬季优势种共有3种,主要优势种为太平洋纺锤水蚤和桡足类六肢幼虫。

Table 7. The dominant species of zooplankton and seasonal changes in the survey area
表7. 调查海域浮游动物优势种及季节变化
2) 浮游动物丰度及生物量平面分布
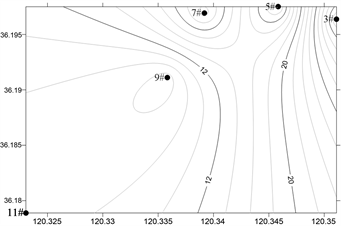
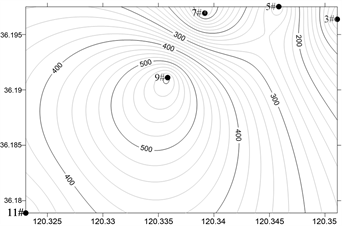
浓海水调查海域浮游动物丰度和生物量平面分布如图6、图7所示,浮游动物总丰度和生物量分布存在季节性差异。
春季,浮游动物总丰度为387.5 ind./m3,最大值出现在9#站位(145 ind./m3),最小值位于3号站位(15 ind./m3);夏季,浮游动物总丰度为167.5 ind./m3,最大值出现在9#站位(70 ind./m3),最小值位于5号站位(12.5 ind./m3);秋季,浮游动物总丰度为245 ind./m3,最大值出现在3#站位(100 ind./m3),最小值位于11号站位(20 ind./m3);冬季,浮游动物总丰度为85 ind./m3,最大值出现在3#站位(40 ind./m3),最小值位于9号站位(5 ind./m3);调查海域浮游动物总丰度春季 > 秋季 > 夏季 > 冬季。
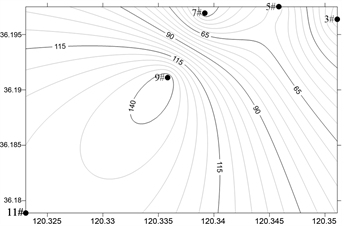
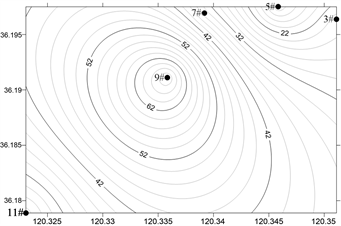 (a) 春季 (b) 夏季
(a) 春季 (b) 夏季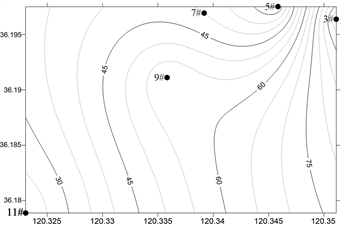
 (c) 秋季 (d) 冬季
(c) 秋季 (d) 冬季
Figure 6. Horizontal distribution of Zooplankton abundance in the survey sea
图6. 调查海域浮游动物丰度的平面分布
 (a) 春季 (b) 夏季
(a) 春季 (b) 夏季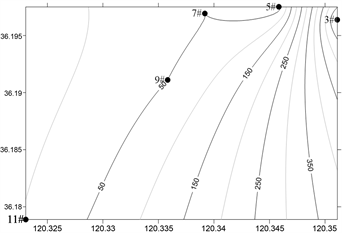
 (c) 秋季 (d) 冬季
(c) 秋季 (d) 冬季
Figure 7. Horizontal distribution of Zooplankton biomass in the survey sea
图7. 调查海域浮游动物生物量的平面分布
调查海域总生物量春季 > 秋季 > 夏季 > 冬季,春季,浮游动物总生物量为1297.5 mg/m3,最大值出现在9#站位(610 mg/m3),最小值位于3#站位(10 mg/m3);夏季,浮游动物总生物量为612.5 mg/m3,最大值出现在9#站位(510 mg/m3),最小值位于5#站位(2.5 mg/m3);秋季,浮游动物总生物量为745 mg/m3,最大值出现在3#站位(510 mg/m3),最小值位于11#站位(2.5 mg/m3);冬季,浮游动物总生物量为107.5 mg/m3,最大值出现在3#站位(50 mg/m3),最小值位于9#站位(5 mg/m3)。
4) 浮游动物群落多样性指数分析
图8(a)~(c)显示了浓海水调查海域浮游动物物种多样性指数、物种均匀度指数和物种丰富度指数的变化情况。调查海域春季浮游动物群落多样性指数H'平均值为2.12,均匀度指数J平均值为0.84,物种丰富度指数d平均值为1.28,7#站位物种数最少,仅为2种,生物多样最差,11#站位发现10种浮游动物,物种多样性最好。夏季浮游动物群落多样性指数H'平均值为2.09,均匀度指数J平均值为0.92,物种丰富度指数d平均值为1.15,各调查站位物种多样性较为接近;秋季浮游动物群落多样性指数H'平均值为1.42,均匀度指数J平均值为0.68,物种丰富度指数d平均值为0.82,各调查站位物种多样性较为接近,3#站位物种数最多达7种,丰度和生物量均较高,物种多样性最好,其他站位较为接近。冬季浮游动物群落多样性指数H'平均值为0.86,均匀度指数J平均值为0.69,物种丰富度指数d平均值为0.42,因9#站位只发现一种浮游动物,其物种多样性为0,各调查站位物种多样性较为接近。总的来看,春夏秋季的物种多样性比冬季好,冬季的浮游动物丰度和生物量均远低于其他3季。
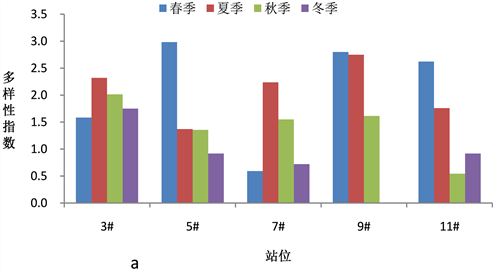
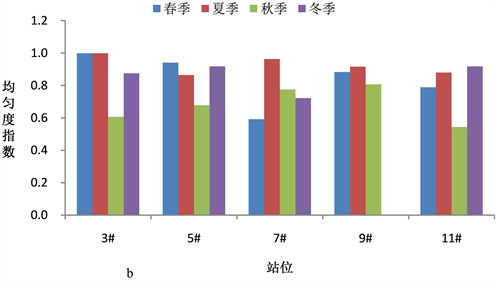
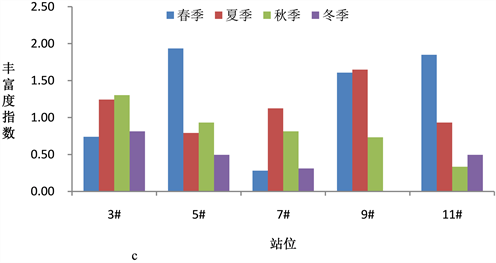
Figure 8. Zooplankton diversity index in the survey area
图8. 调查海域浮游动物多样性指数
4. 讨论
4.1. 浓海水排水海域海水水质环境
青岛百发海水淡化浓海水排水口位于楼山河入海口上游50米处,在排放口下游约900米范围内,是大片的滩涂地带,中间有一条较深的潮沟,涨潮时滩涂被海水淹没,落潮时则裸露出来。落潮时含有浓海水的混合水流沿此潮沟流入海洋水体,在潮沟中可以监测到盐度梯度的存在。楼山河入海口附近有污水处理场排水和其他废水排放,由于波浪和潮汐的作用,海水水平运动强烈,稀释扩散作用较强,排放的浓海水被瞬间稀释,调查期间各站位盐度相差不大。
水质调查结果发现浓海水排放相关海域无机氮浓度超标,但靠近浓海水排水口的站位无机氮浓度并没有明显高于远离排水口的站位,而且通过对海水淡化厂浓海水的检测发现,海水淡化浓海水中无机氮浓度与调查海域无机氮浓度接近,说明无机氮超标与浓海水排海没有直接关联。除无机氮外,其它水质监测指标数值远低于四类海水要求的数值,部分调查站位无机磷和重金属等指标达到第二类海水水质标准要求。
4.2. 海水淡化浓海水生态环境监测
4.2.1. 浮游植物
浮游植物群落是海洋生态系统中最重要的初级生产者,其种类和数量的分布对维持海洋生态平衡具有重要作用。海水水质环境的变化可能直接或间接影响浮游植物群落结构,研究浮游植物群落结构及其季节变化,可了解海水淡化浓海水排放对海洋生态环境的影响程度和范围。
全年4个季度调查共鉴定发现浮游植物31属49种,其中硅藻26属44种,甲藻5属5种。浮游植物生态类型主要为温带近岸种和广布种,少数为暖水种。
研究 [26] 表明,海水运动和海域中的营养盐浓度是影响浮游植物空间分布的主要因子,楼山河入海口处流速较大,水深较浅,海水垂直混合作用较好,水交换能力强,离岸较近的调查站位浮游植物丰度低于离岸稍远的站位。秋季浮游植物的丰度和种类远高于其他3季,可能与9月份降雨量增多,夏、秋季盐度低于春秋两季,这也从侧面印证了秋夏季汇入浓海水排放海域的径流量较大,陆源输入海洋的营养盐较多。
平均浮游植物细胞丰度达到1.08 × 107 cells/m3,浮游植物细胞丰度最高峰出现在9月份,与胶州湾历史监测接近,与历史调查结果一致 [27] [28] [29] ,浮游植物的数量可反映该海域的初级生产力水平。因浓海水排放影响范围很小,调查站位主要处于近岸海域,鉴定发现的浮游植物种属比胶州湾常规调查要少,但主要和优势种类均为胶州湾常规调查出现物种。
Shannon-weaver多样性指数可评判海水水质优劣,规定0~1高度污染,1~2 中度污染,2~3轻度污染,3~4清洁海域,本次调查海域全年浮游植物多样性指数在2~3之间,调查海域为轻度污染,与海水水质评价结果相当。
4.2.2. 浮游动物
浮游动物作为次级生产者参与海洋生态系统物质和能量的流通,对海洋生态系统结构平衡起着重要的调节作用。浮游动物的种类组成和丰度能够及时反映所在海域的环境变化,其群落结构多样性随海水盐度、温度、叶绿素a和营养盐浓度变化而表现出差异性,了解浓海水排放海域的海洋浮游动物群落结构特征,对研究海水淡化浓海水排放的环境影响具有重要意义。
4个季度调查共鉴定出浮游动物成体20种,其中春季8种,夏季7种,秋季7种,冬季7种;另发现浮游幼虫10种,其中春季7种,夏季5种,秋季5种,冬季1种。种类组成方面,节肢动物类 15 种,浮游幼虫10种,腔肠动物2种,原生动物、毛颚类和尾索动物均只有1种。
节肢动物和浮游幼虫占据优势,这与历史调查结果相似,说明浓海水排放未改变海域浮游动物的结构组成。本次调查浮游动物群落主要优势种有洪氏纺锤水蚤、捷氏歪水蚤、刺尾歪水蚤、短角长腹剑水蚤、肥胖三角溞、异体住囊虫、桡足类六肢幼虫等,优势种类数与历史调查也有不同,因调查主要是为了考察浓海水排放对海域可能产生的环境影响,调查站位布设较为集中,楼山河入海口附近海域易受陆源排水影响,海水温度、盐度、营养盐浓度等的变化等造成浮游动物群落结构发生演替现象。
调查海域浮游动物丰度和生物量存在季节变化情况,浮游动物丰度和生物量均呈现春季 > 秋季 > 夏季 > 冬季,春季调查海域各站位浮游动物群落平均丰度和生物量分别为77.5 ind./m3和259.5 mg/m3,这与历史调查监测 [30] [31] 结果基本相符,表明浓海水排放未改变浮游动物丰度和生物量在季节变化方面的基本趋势。
5. 结论
1) 青岛百发海水淡化浓海水排放未对海水水质产生明显影响,调查海域海水水质环境没有明显变化。
2) 生态影响方面,海水淡化浓盐水排放海域海洋浮游生物的种类、数量、优势种大多未发生明显变化,生物群落结构较为稳定,说明在短期内,海水淡化浓海水排放未对周边海域生态环境产生影响。
3) 目前国内大型海水淡化工程浓海水多采用与其它生产废水混合排放,或者进行综合利用零排放,可供选取的用于浓海水排海环境影响调查的典型海水淡化实际工程数量较少,而且海水淡化浓海水排海对海洋环境的影响是一个长期累积的过程。以后还需进行包括潮间带生物和底栖生物的长期连续调查监测,以科学准确评估海水淡化浓海水排海对海洋生态环境的影响。
致谢
感谢青岛百发海水淡化有限公司生产技术部李柯部长和梁俊哲高级工程师对调查采样工作的支持和帮助。
基金项目
中央级公益性科研院所基本科研业务费专项资金项目(K-JBYWF-2021-ZD01);山东省社科规划重大项目(22AWTJ54);自然资源部业务支撑项目(YWZC2021-13)。