Комбинированный метод лечения постпневмонэктомических бронхиальных свищей: новое звучание старой проблемы
- 1Одесский национальный медицинский университет, Одесская областная клиническая больница
- 2Одесский национальный медицинский университет, Одесский областной клинический онкологический диспансер
Резюме. Вступление. Пневмонэктомия является востребованной операцией в торакальной хирургии и онкохирургии. Главным хирургическим осложнением этой операции является постпневмонэктомический бронхиальный свищ (ПЭБС). Летальность при развитии этого осложнения высокая, единого подхода к лечению нет. Цель. Изучить эффективность лечения пациентов с ПЭБС комбинированным методом, сравнить результаты такой терапии с результатами лечения другими методами. Материал и методы. Проведен ретроспективный анализ результатов консервативного, консервативно-эндоскопического и комбинированного методов лечения ПЭБС. В зависимости от метода лечения пациенты были распределены на 3 группы: пациенты, которых лечили консервативным методом (n=10), пациенты, которых лечили консервативно-эндоскопическим методом (n=9) и пациенты, которых лечили комбинированным методом (n=8). Результаты. В первой группе летальность вследствие ПЭБС и связанных с ним осложнений составила 70%, полностью выздоровевших не было; во второй группе летальность вследствие ПЭБС и связанных с ним осложнений составила 44,5%, выздоровевших пациентов — 44,5%; в третьей группе летальность непосредственно вследствие ПЭБС и осложнений, связанных с ним составила 0%, летальность от прогрессирования онкологического заболевания на фоне лечения ПЭБС составила 25%, удельный вес пациентов с полностью зажившим ПЭБС составила 87,5%, полностью завершили лечение 75% пациентов. Выводы. Считаем, что применение комбинированного метода лечения ПЭБС дает реальные позитивные результаты, значительно снижает летальность среди пациентов в случае использования его по показаниям, с помощью этого метода можно излечить больных после неудачного использования других вариантов лечения ПЭБС.
Получено: 12.05.2020
Принято в печать: 06.07.2020
DOI: 10.32471/clinicaloncology.2663-466X.37-1.26901
Вступление
Пневмонэктомия до настоящего времени является достаточно востребованной в торакальной хирургии и торакальной онкохирургии операцией. Основными показаниями к ней являются: рак легкого І и ІІ стадий и в составе комбинированного лечения ІІІА стадии немелкоклеточного рака легкого (33–50% всех радикальных операций при этой патологии по данным разных авторов [1, 2]), значительно реже — злокачественные опухоли другой морфологии, иногда — доброкачественные опухоли. Операция применяется также во фтизиохирургической практике — главным образом при односторонних поражениях: поликавернозном процессе в одном легком, фиброзно-кавернозном туберкулезе с обширным бронхогенным обсеменением, гигантской каверне, обширном поражении легкого, осложненном эмпиемой плевральной полости [3], в общеторакальной практике — в лечении гангрены легкого. Следует отметить, что пневмонэктомии (ПЭ), применяемые в онкохирургической практике по методологии отличаются от ПЭ, применяемых для хирургического лечения других заболеваний: в онкохирургии ПЭ дополняются ипсилатеральной (значительно реже билатеральной) лимфодиссекцией — зоны 4–14 (по показаниям 3а/р-14), поэтому анатомия оперированной плевральной полости после выполненных вмешательств достаточно существенно отличается. Главным хирургическим осложнением ПЭ является постпневмонэктомический бронхиальный свищ (ПЭБС). По данным разных авторов, частота постпневмонэктомических бронхиальных свищей колеблется в пределах 0–20% [2]. По данным Д.А. Чичеватова, средняя частота ПЭБС составляет 6% [4]. Частота летальности при ПЭБС, по информации, например, P.H. Hollaus и соавторов (1997), составляет 67% [5]. По данным Д.А. Чичеватова, частота ПЭБС справа в 5 раз выше, чем при левосторонних операциях [4]. По нашим наблюдениям, частота ПЭБС справа в 2 раза превышает таковую слева. Основные причины ПЭБС: недостаточное кровоснабжение (в том числе и в результате медиастинальной лимфодиссекции) культи главного бронха и наличие бактериального эндобронхита. Среди прочих факторов, которые упоминаются в литературе как факторы риска развития ПЭБС, следует указать правую сторону операции, предоперационную лучевую и/или химиотерапию, метод обработки культи бронха, рост опухоли по линии резекции бронха, стадию рака легкого, ХОЗЛ, сахарный диабет, наличие длинной культи бронха [4].
Одним из наиболее эффективных современных методов лечения ПЭБС является установка септального окклюдера. По данным некоторых авторов, эффективность данного метода составляет около 75% [6–9], но метод нуждается в дальнейшем изучении из-за небольшого количества наблюдений. Во многих странах хирурги при ранних ПЭБС используют оментопластику культи главного бронха (с последующими рецидивом у 25% пациентов и летальностью почти 27%), а при поздних ПЭБС — оментоторакопластику (после ранее наложенной торакостомы и относительной санации плевральной полости) — процент рецидивов составляет около 17%, точный процент летальности не указывается, при этом выполнить оментоторакопластику после ранее наложенной торакостомы по разным причинам возможно менее чем у половины пациентов [4].
Не всегда удовлетворительные результаты лечения ПЭБС, даже казалось бы самыми новыми и прогрессивными методами, подталкивают к дальнейшим изысканиям по данной проблеме. Имея многолетний опыт лечения больных ПЭБС, авторы данной статьи пришли к новому, комбинированному методу терапии ПЭБС, который во многих случаях показал удовлетворительные результаты и которым считают своим долгом поделиться со специалистами в данной статье.
Материалы и методы
Проведен ретроспективный анализ результатов лечения 27 пациентов с развившимся ПЭБС, взятых из выборки — 200 пациентов, которыми была выполнена ПЭ за период 2007–2019 гг. по поводу немелкоклеточного рака легкого (НМКРЛ) ІВ–ІІІА стадий (n=196), мелкоклеточного рака легкого (МКРЛ) ІВ–ІІА стадий (n=1), массивного солитарного метастаза саркомы мягких тканей в правое легкое (n=1), массивного солитарного метастаза рака прямой кишки в правое легкое (n=1), доброкачественной опухоли правого легкого (n=1). Возраст больных находился в диапазоне 29–77 лет. Из 27 пациентов с ПЭБС 26 составляли мужчины и только 1 — женщина. Размер ПЭБС варьировал у разных больных: от 0,2 см до 2,5 см (полный свищ). Всем пациентам с НМКРЛ и МКРЛ выполняли лимфодиссекцию в объеме Д1 или Д2. Частота развития бронхиальных свищей составила 13,5% (всего 27 пациентов), из них 33,35% — левосторонние (9 пациентов) и 66,6% — правосторонние (18 пациентов). Все больные, у которых развился ПЭБС, были разделены на 3 группы. В первую группу вошли 10 пациентов, у которых лечение ПЭБС заключалось в дренировании плевральной полости и санации ее водными растворами антисептиков (консервативный метод). Вторую группу составили 9 пациентов, у которых лечение ПЭБС заключалось в дренировании плевральной полости, санации ее водными растворами антисептиков, а также выполнялись эндоскопические прижигания свища (через фибробронхоскоп под местной анестезией) 0,1–0,3 мл 50% раствора трихлоруксусной кислоты, всего от 2 до 5 курсов (консервативно-эндоскопический метод). В третью группу вошли 8 пациентов, у которых лечение ПЭБС заключалось в применении комбинированного метода.
Суть комбинированного метода заключалась в следующем: после диагностирования ПЭБС, выполнения дренирования остаточной плевральной полости, стабилизации общего состояния пациента (около 2–7 дней) выполняли:
- наложение торакостомы длиной 12–14 см со стороны первой операции (на уровне передних отрезков 3–5-го или 4–6-го ребер);
- тампонирование остаточной плевральной полости большими (50×75 см) стерильными марлевыми салфетками пропитанными 1–2% водным раствором повидон-йода (при непереносимости йод-содержащих препаратов — водным раствором другого подходящего антисептика);
- спустя 3–7 дней после наложения торакостомы — прижигание краев бронхиального свища 50% водным раствором трихлоруксусной кислоты через торакостому, при необходимости — через торакостому и фибробронхоскоп (фибробронхоскопия выполнялась под местной анестезией).
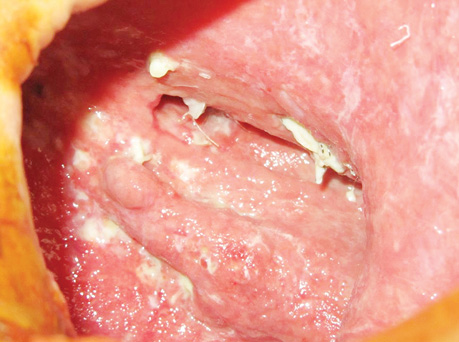
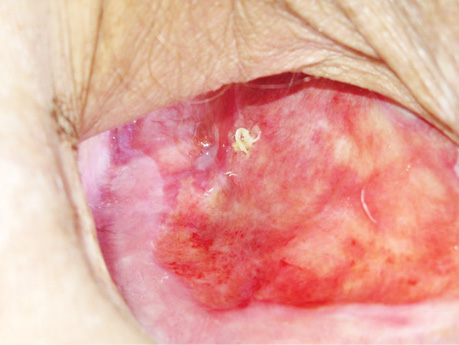
Прижигание бронхиального свища через торакостому осуществляли с помощью длинного зажима: небольшой ватный шарик или палочка с ватой захватывается зажимом и опускается в емкость с 50% водным раствором трихлоруксусной кислоты, шарик отжимают, удаляя избыточное количество кислоты, и дотрагиваются им на несколько секунд до краев бронхиального свища, после чего края свища покрываются белым струпом, несколько деформируются. Процедуру выполняли 1 раз в 3–5 сут, на один курс — 7–8 процедур; затем на 4–5 нед делали перерыв до следующего курса, если он будет необходим (курсов было от 1 до 3, реже до 9). Естественно, в перерывах между курсами ежедневно продолжают перевязки. Перерыв между курсами необходим для восстановления тканей от прижигающего действия 50% раствора трихлоруксусной кислоты. Если несколько затруднен доступ к краям бронхиального свища, то в тот же или на следующий день (после прижигания ПЭБС через торакостому) можно дополнительно прижечь края ПЭБС через фибробронхоскоп (до 0,2–0,3 мл 50% водного раствора трихлоруксусной кислоты изливают строго на края свища с помощью гибкого эндоскопического катетера). Ежедневно выполняют перевязки остаточной плевральной полости большими (50×50 или 50×75 см) салфетками, пропитанными 1–2% раствором повидон-йода (при непереносимости йодсодержащих препаратов — водным раствором другого подходящего антисептика). Количество салфеток варьирует от 1 до 16, они поочередно погружаются в лоток с раствором антисептика, тщательно отжимаются для удаления его избытка, тампонируется полость и накладывается асептическая повязка (1–2 марлевые салфетки). Постепенно ПЭБС ликвидируется, остаточная плевральная полость относительно очищается, резецированные ребра погружаются в грануляции, полость значительно уменьшается. Бронхиальный свищ закрывается, вследствие разрастания грануляционной ткани в сроки от 1 до 14 мес (в нашем исследовании у 5 больных ПЭБС зажил в сроки 1,5–7 мес (в том числе 2 больных с полным свищом), еще у 2 — в сроки 13–14 мес), в зависимости от размеров свища и скорости репаративных процессов организма пациента. После ликвидации бронхиального свища есть 2 варианта окончания процесса лечения:
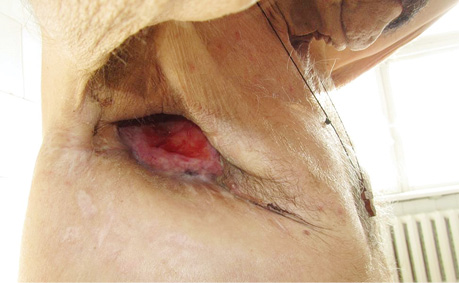
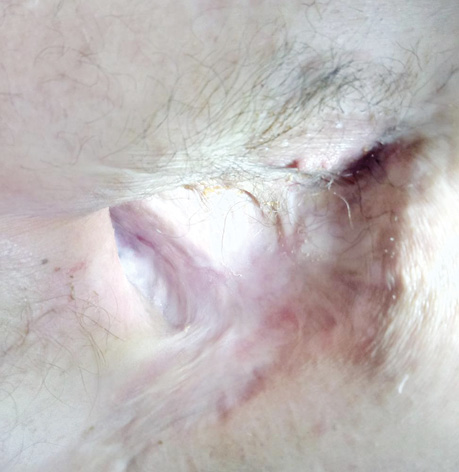
- выполняется дополнительная санация остаточной плевральной полости растворами антисептиков, в случае успешной санации выполняют ушивание торакостомы, оставляя дренаж на некоторое время, в случае значительного диастаза краев торакостомы — выкраивают и перемещают кожно-фасциально-мышечный лоскут (перемещенный лоскут) грудной стенки и сшивают с противоположным краем торакостомы (края торакостомы предварительно иссекают), дополнительно, на некоторое время, дренируют ушитую полость по Бюлау, вскоре дренаж убирают, рана заживает;
- в случае, если полностью санировать остаточную плевральную полость не удается, выполняют перевязки с уменьшением количества салфеток с 1–2% раствором повидон-йода, полость уменьшается, постепенно полностью покрывается кожей снаружи внутрь, перевязки выполняются до полного заживления, на этом лечение можно закончить либо для большей защиты средостения необходимо иссечь края торакостомы, обработать полость антисептиками и ушить кожные края торакостомы, оставить небольшой дренаж между швов, в процессе заживления его убрать и, наконец, не ранее чем через 2 нед, снять швы, либо для закрытия полости можно использовать, как в первом варианте, перемещенный лоскут. Если в процессе лечения диагностирована пролонгация онкологического заболевания, то прижигания ПЭБС прекращают и выполняют только перевязки, как правило, ежедневно.
Результаты
ПЭБС в послеоперационный период развились у 27 пациентов, что составило 13,5%. 9 из них — после левосторонних операций (33,55%) и 18 — после правосторонних (66,55%). В первой группе летальность (до 1,5 мес от момента возникновения свища) непосредственно вследствие ПЭБС и связанных с ним осложнений составила 70% (7 из 10 пациентов), полностью выздоровевших не было. Во второй группе летальность непосредственно вследствие ПЭБС и связанных с ним осложнений составила 44,4% (4 из 9 пациентов); выздоровевших пациентов — 44,4% (4 из 9 пациентов), еще у 1 пациента лечение было безуспешным, но без летального исхода. В третьей группе летальность непосредственно вследствие ПЭБС и связанных с ним осложнений была 0%, летальность вследствие прогрессирования онкологического заболевания на фоне лечения ПЭБС составила 25% (2 из 8 пациентов), удельный вес пациентов с полностью зажившим ПЭБС — 87,5% (7 из 8 пациентов), полностью завершивших лечение — 75% больных (6 из 8) — данные обобщены в таблице; у оставшихся 2 пациентов причинами незавершенности лечения были: у первого пациента ПЭБС закрылся, но полностью санировать плевральную полость и закрыть торакостому не удалось из-за прогрессирования онкологического заболевания на фоне лечения ПЭБС комбинированным методом (пациент с ІІІА стадией НМКРЛ); у второго пациента (с ІІВ стадией МКРЛ) ПЭБС имел тенденцию к заживлению, однако из-за раннего прогрессирования онкозаболевания на фоне лечения ПЭБС (пациент с ІІВ стадией МКРЛ) завершить лечение также не удалось (с момента прогрессирования заболевания выполняли только перевязки). В процессе лечения возможны «рецидивы» ПЭБС (микро или совсем небольшие), но они полностью ликвидируются повторными курсами прижигания. Следует отметить, что если перед ПЭ или после нее проводили химио- или лучевую терапию, то заживление свища задерживается. Если есть опухолевый рост в культе бронха и ПЭБС — заживление ПЭБС при использовании данного метода скорее всего невозможно (в нашем исследовании таких пациентов не было).
Таблица. Клиническая характеристика пациентов, включенных в исследование
| Клиническая характеристика группы | группы | ||
| 1 | 2 | 3 | |
| Количество пациентов | 10 | 9 | 8 |
| Средний возраст, лет | 59, 8 (56–70) | 62, 7 (54–75) | 59, 6 (53–72) |
| Пол: мужской (n=26)
женский (n=1) |
9 (90%) | 9 (100%) | 8 (100%) |
| 1 (10%) | 0 (0%) | 0 (0%) | |
| Сторона операции: справа n=18 (66,65%)
слева n= 9 (33,35%) |
10 (100%) | 4 (44,5%) | 4 (50%) |
| 0 (0%) | 5 (55,5%) | 4 (50%) | |
| Первичная патология, по поводу которой была выполнена пульмонэктомия | |||
| НМКРЛ ІВ–ІІІА стадия (n=23) | 9 (100%) | 8 (77,8%) | 6 (75%) |
| МКРЛ ІІВ стадия (n=1) | 0 (0%) | 0 (0%) | 1 (12,5%) |
| Солитарный метастаз саркомы мягких тканей (n=1), солитарный метастаз рака прямой кишки (n=1) | 0 (0%) | 2 (22,2%) | 0 (0%) |
| Доброкачественное новообразование легкого (n=1) | 0 (0%) | 0 (0%) | 1 (12,5%) |
| Летальность вследствие ПЭБС и связанных с ним осложнений (n=11) | 7 (70%) | 4 (44,5%) | 0 (0%) |
| Количество полностью выздоровевших пациентов (n=10) | 0 (%) | 4 (44,5%) | 6 (75%) |
| Количество пациентов, у которых зажил свищ (n=11) | 0 (0%) | 4 (44,5%) | 7 (87,5%) |
Обсуждение
Мало при какой патологии в медицине вообще было предложено такое множество разнообразных методов лечения. Торакальная хирургия в этом плане, с момента своего существования, находится в постоянном поиске новых решений.
Лечение реализовавшегося ПЭБС представляет из себя весьма сложную задачу. Традиционно методы лечения данной патологии делятся на оперативные и консервативные. Также выбор метода лечения зависит от того, ранний (1–2 сут с момента возникновения до развития вторичной эмпиемы плевры) или поздний ПЭБС (с развившейся вторичной эмпиемой плевры).
Независимо от того, отмечают ранний или поздний ПЭБС, лечение, как правило, начинается с диагностической плевральной пункции, а при получении в шприце воздуха, отсутствия герметичности остаточной плевральной полости и, следовательно, диагностирования ПЭБС — выполняется ее дренирование. Стабилизация общего состояния больного, как правило, наступает в течение первых суток после установки дренажа. Весьма сложный вопрос для хирурга: как поступать дальше? Консервативное лечение ПЭБС, в основном, рассматривается при лечении свищей до 3 мм [10]. При применении фибринового клея смогли добиться выздоровления 20% пациентов, при использовании лазера, прижигания свища химическими компонентами или подслизистого введения склерозирующих веществ выздоравливают 33–58% больных с уровнем летальности 26–66%. Общая смертность в 5 лучших сериях наблюдений эндоскопического лечения свищей составила 39,6%. Из 89 пациентов с ПЭБС и ассоциированными с ними с эмпиемами авторам удалось вылечить только 30,1% [4].
В литературе есть устоявшееся мнение, что все бронхиальные свищи до 3 мм хорошо и достаточно быстро закрываются при применении классических консервативных (в первую очередь с использованием фибробронхоскопических методов лечения, можем утверждать: у части больных это действительно так, у другой части — нет, причем на протяжении очень длительного времени свищи персистируют и, естественно, представляют угрозу жизни пациентов. У части пациентов ПЭБС, на фоне неудачного лечения, прогрессирует, то есть увеличивается в размерах, причем существенно.
Некоторые зарубежные клиники используют септальные окклюдеры для эндоскопического лечения ПЭБС и это, возможно, одно из наибольших достижений в лечении ПЭБС в последние годы, однако отзывы о методике разнятся: в некоторых сообщениях статистика не приводится — лишь указывают на то, что большинству больных показано оперативное лечение, в других сообщениях — указывают, что метод надежен, быстр в исполнении и эффективен у большинства больных [6]. Данные устройства изначально предназначены для транскатетерного закрытия дефектов межжелудочковой и межпредсердной перегородок. Суть метода состоит в том, что септальный окклюдер, подобранный предварительно по размеру, в том числе при помощи фибробронхоскопии, компьютерной томографии, а также с применением баллона-измерителя и электронно-оптического преобразователя с С-дугой, таким образом, что он на 30% больше размеров свища, устанавливается в отверстие, детали процедуры зависят от того, имеется ли ранее наложенная торакостома у пациента либо установлен только трубчатый дренаж. Техника установки окклюдера при наличии торакостомы следующая. Через торакостому визуализируется свищ. При фибробронхоскопии через рабочий канал бронхоскопа в свищ выводится проводник. Проводник захватывается из плевральной полости и выводится наружу. К проводнику фиксируется окклюдер, который, затем, путем тракции затягивается в бронхиальный свищ (попутно выполняется деэпителизация свищевого канала при прохождении через него окклюдера). Состояние наружного и внутреннего дисков контролируется, соответственно, из просвета торакостомы и из просвета трахеобронхиального дерева. При удовлетворительном его стоянии проводник отсоединяется, бронхоскоп извлекается, торакостома тампонируется вновь. Техника установки окклюдера при наличии дренажа в плевральной полости следующая: выполняется видеоторакоскопия, визуализируется через торакоскоп свищ со стороны плевральной полости. Под визуальным контролем в удобном месте вводится еще один троакар. Далее в трахеобронхиальное дерево вводится фибробронхоскоп. Проводник для окклюдера вводится в канал бронхоскопа, проводится через свищевое отверстие в плевральную полость, где подхватывается и выводится наружу через торакопорт. Окклюдер прикручивается к проводнику, вводится через торакопорт в плевральную полость и путем тракции за проводник затягивается в свищ. Контроль положения и расправления внутреннего диска осуществляется через фибробронхоскоп, наружного — через торакоскоп. Убедившись, что окклюдер стоит правильно, отсоединяют окклюдер от проводника и извлекают бронхоскоп. Устраняют торакоскоп, оставляя дренаж в плевральной полости для промывания плевральной полости [6]. Авторы, использовавшие данный метод, утверждают, что при его применении одно условие является непременным — наличие сформировавшегося свища с ригидными краями, что предохраняет от надрыва и дальнейшего расхождения культи во время установки плага (окклюдера). Но стоит отметить, что в первые несколько недель существования ПЭБС это условие как раз, в основном, и не выполняется, в связи с чем этот метод едва ли можно с успехом использовать при ранних свищах. В некоторых случаях, при увеличении размеров свища окклюдер самопроизвольно выпадает с последующим рецидивом ПЭБС, в других случаях указывают на то, что при кашле в течение нескольких месяцев может просачиваться воздух между окклюдером и тканью культи бронха, иногда озвучивают проблему, которая заключается в несоответствии окклюдера и свища по размерам, часто свищи имеют неправильную, необычную форму: например «двойной» свищ культи бронха с перемычкой ткани между ними, не следует забывать также, что изначально септальный окклюдер рассчитан на стерильные условия в камерах сердца, но совсем другая среда в плевральной полости при наличии эмпиемы. Тем не менее метод следует признать интересным и, возможно (это покажет будущее), эффективным у как можно большего количества пациентов с проблемой ПЭБС.
Некоторые авторы сообщают об успешном применении клеточных технологий в лечении ПЭБС размером до 5 мм [11] (на этом методе подробно останавливаться не будем).
Таким образом следует отметить, что низкая эффективность и высокая летальность при применении классических методик консервативного лечения ПЭБС не позволяют считать их результаты удовлетворительными. Современная методика с использованием септальных окклюдеров вселяет оптимизм, но, по-видимому, не является абсолютным решением проблемы ПЭБС.
Что касается выбора методики оперативного лечения, то это принципиально зависит от того, ранний или поздний ПЭБС, выполнена ли операция с лимфодиссекцией или без нее. Также учитывают размеры свища, длину бронхиальной культи, сторону поражения, общее состояние пациента. Последнее условие подчас является решающим в вопросе, возможна ли операция вообще. При раннем ПЭБС, после операций, выполненных с лимфодиссекцией, многими авторами рекомендуется оментопластика в различных модификациях. Эти операции достаточно хорошо изложены, например, в книге Д.А. Чичеватова [4]. Летальность при подобных операциях составляет 26,7%, рецидив свища — около 25% [4]. Наш опыт показывает, что освоить подобные операции непросто и рецидивы на этапе освоения возникают значительно чаще. В случае неонкологических ПЭ (без лимфодиссекции) данные операции едва ли могут быть применены. Следует отметить, что повторное ушивание свища или ререзекция культи бронха, пусть даже с пластикой лоскутом париетальной плевры на ножке, перикардиальным лоскутом, жировым подвеском перикарда редко бывают эффективными [4]. Некоторые авторы с определенным успехом при ПЭБС используют операцию — циркулярную резекцию бифуркации трахеи. Но с нашей точки зрения, данная методика обладает определенными недостатками: 1) сложна в выполнении, владеет ею далеко не каждый торакальный хирург; 2) выполняется в условиях воспаления, в связи с чем и без того достаточно большой процент несостоятельности трахео-бронхиального анастомоза и других осложнений еще более увеличивается (в сравнении с подобными операциями, выполненными в асептических условиях) и лечить эти осложнения, если они возникли, еще сложнее, чем ПЭБС, 3) не каждый пациент с ПЭБС по своему соматическому статусу, может перенести такое сложное оперативное вмешательство. По данным О.О. Ясногородского, радикальная операция при бронхиальном свище оказалась возможной только у 33,7% [12] из наблюдавшихся пациентов, по данным P.H. Hollaus и соавт. — у 68,7% [13]. У остальных больных этому препятствовали некорригируемая тяжесть общего состояния и активность гнойного процесса.
Что касается лечения поздних ПЭБС, наиболее рациональным вариантом хирургического вмешательства является наложение торакостомы с последующими перевязками [4], причем у некоторых больных в первую неделю после наложения торакостомы следует выполнять перевязки 2 раза в сутки (зависит от количества гнойного отделяемого). После относительной санации остаточной плевральной полости, больному может быть предложена оментоторакопластика, выполняемая в таких ситуациях по разным причинам менее чем половине таких пациентов, а также имеющая долю летальности 27%, долю рецидива — около 18%. Тем не менее, торакостомия, как правило, спасает жизнь пациенту: после этой операции состояние больного значительно улучшается, санация плевральной полости приводит к относительному ее очищению и гранулированию, быстро исчезают симптомы гнойной интоксикации, нормализуется общее состояние пациента, эмпиема остаточной плевральной полости постепенно (но при оставшемся свище — полностью никогда!)ликвидируется, угроза сепсиса исчезает, риск пневмонии противоположного легкого сводится к минимуму. Однако данная операция не является пособием, вследствие которого исчезает ПЭБС. Основным показанием к ее выполнению является санация эмпиемы плевры на фоне ПЭБС, что дает возможность подготовить больного к реконструктивному этапу хирургического лечения [14]. За годы применения данного оперативного пособия (торакостомии) при ПЭБС прояснились следующие обстоятельства:
- при ПЭБС с развившейся вторичной эмпиемой плевры, торакостома реально спасает жизнь пациенту, с ее наложением не стоит затягивать (при поздних свищах), так как у больного может развиться аспирационная пневмония единственного легкого, флегмона грудной стенки, сепсис, острые стрессорные язвы ЖКТ с кровотечением из них или перфорацией, и вследствие какой-то из этих причин — летальный исход;
- как правило, ПЭБС после наложения торакостомы спонтанно не гранулирует;
- полной санации остаточной плевральной полости не происходит.
Некоторые авторы продолжают использовать ставшие классическими операции на культях бронхов. Касательно выбора оперативного доступа к культям главных бронхов, по-прежнему используются 3 варианта: гомолатеральный, трансстернальный и контралатеральный, применяемый при левосторонних свищах. Суть операций сводится к доступу к культе бронха, реампутации и реушивании ее, часто с использованием миопластики (торакодорсальный, межреберный мышечные лоскуты). Эффективность этих операций, по данным авторов, составляет 81,8–89,8%, по другим данным — значительно ниже. Послеоперационная летальность, по данным тех же авторов, составляет от 3,8% до 18,2% [6, 15–17]. Таким образом, наряду с определенной эффективностью, реконструктивные операции по поводу свищей культей главных бронхов представляют собой серьезную хирургическую травму, обусловленную трудностью хирургического доступа к культе бронха, будь то доступ через постпневмонэктомическую полость, либо трансстернально-трансперикардиально, либо через противоположную плевральную полость. Подчеркивается, что такие вмешательства сопровождаются определенным хирургическим риском и, следовательно, могут быть выполнены далеко не у каждого пациента с ПЭБС.
Что касается профилактики ПЭБС, не останавливаясь подробно на этом аспекте проблемы, все-таки хотим отметить:
- при обработке культи главного бронха ручным способом или с помощью современных одноразовых линейных сшивающих аппаратов частота развития ПЭБС снижается по сравнению с обработкой культи главного бронха многоразовыми линейными сшивающими аппаратами типа УО-40 и УО-60, но не нивелируется;
- значительного профилактического эффекта достигают с помощью «лоскутной» пластики культи главного бронха, наиболее эффективной и приемлемой в торакальной онкохирургической практике является методика диафрагмопластики культи главного бронха по Д.А. Чичеватову (по мнению авторов данной статьи), данная методика очень подробно описана в его книге «Диафрагмальный и сальниковый лоскуты в грудной хирургии» [4]. Этим же автором описана аналогичная методика оментопластики культи главного бронха, которая для профилактики ПЭБС применяется в случае невозможности использования диафрагмального лоскута у данного пациента (по разным причинам). Частота развития ПЭБС, по данным автора, — 2,63%.
Но данные методики имеют некоторые ограничения:
- технически методики идеально подходят для «правосторонних» операций и значительно сложнее в выполнении при «левосторонних» операциях;
- данные методики рассчитаны на операции, выполненные с лимфодиссекцией, то есть на онкологические операции, и неприменимы к ПЭ, выполненным без лимфодиссекции.
Некоторые авторы сообщают о способе профилактики ПЭБС, заключающемся в ушивании раны средостения с полной изоляцией зоны культи бронха от свободной плевральной полости, частота развития ПЭБС, по их данным, — 1,6% [18].
Таким образом, даже с помощью самых лучших современных методик, профилактировать развитие ПЭБС на 100% не удается.
Комбинированный метод лечения ПЭБС эффективен у большинства пациентов, и лишь у тех из них, у кого на фоне лечения данным методом наблюдается пролонгация онкологического заболевания, не удается закончить лечение полностью. Еще одним из достоинств данного метода, помимо эффективности, является отсутствие летальности, непосредственно в следствии его использования.
Эффективность комбинированного метода основана на следующем:
- торакостома устраняет дефицит дренирования гнойной полости, благодаря чему устраняется интоксикация и отравление организма пациента гноем, создаются благоприятные условия для закрытия ПЭБС благодаря последующим прижиганиям его краев;
- прижигания краев бронхиального свища вызывают химическое воспаление, активацию местных стволовых клеток и рост грануляционной ткани до полного соприкосновения и ликвидации ПЭБС.
Мы считаем, что метод может быть применен в следующих случаях:
- наличие ПЭБС с присоединившейся вторичной эмпиемой плевры, то есть при позднем свище (заметим, что во многих случаях «ранние» ПЭБС становятся «поздними» вследствие неудач их лечения);
- рецидив ПЭБС после применения оперативных методик его закрытия;
- ПЭБС, при которых эндоскопические методы его лечения оказались неэффективными.
Выводы
- Проблема ПЭБС в торакальной хирургии и онкохирургии по-прежнему актуальна, несмотря на все достижения в вопросах его профилактики.
- Лечение ПЭБС представляет собой сложную задачу, до недавнего времени прогноз для пациентов во многих случаях был неудовлетворительным.
- Классические консервативные методы лечения, в том числе эндоскопические, недостаточно эффективны, причем на фоне высокой летальности.
- Метод лечения с использованием септальных окклюдеров вселяет оптимизм, но нуждается в дальнейшем изучении.
- Современные оперативные методы лечения ПЭБС сложны, в определенных, но не во всех случаях эффективны, летальность, связанная с их использованием, достаточно высока, они могут быть применены далеко не у всех больных с ПЭБС.
- В случае выполнения правосторонней ПЭ с лимфодиссекцией до Д2 (при онкологическом заболевании) весьма эффективна превентивная диафрагмо- (оменто-) пластика культи главного бронха по Д.А. Чичеватову. Однако данная операция не показана (из-за технических особенностей) в случае выполнения неонкологической операции. Данное хирургическое вмешательство значительно сложнее в выполнении в случае левосторонних онкологических операций. Таким образом, даже с помощью самых лучших современных методик, профилактировать развитие ПЭБС на 100% не удается.
- Учитывая все вышеизложенное, появление комбинированного метода лечения ПЭБС весьма актуально; без сомнения, метод будет серьезным подспорьем в арсенале торакальных хирургов и онкохирургов в случае их столкновения с проблемой ПЭБС у пациентов. Применение метода дает реальные результаты, значительно снижает летальность в случае его использования, когда он показан (см. выше) и, что немаловажно, с его помощью можно полностью излечить пациентов после неудачного использования других методов лечения ПЭБС. У метода практически нет противопоказаний, не наблюдается летальности непосредственно вследствие его использования, так как наложение торакостомы, прижигание бронхиального свища и перевязки относительно легко переносятся пациентами. Что немаловажно, он технически несложен в выполнении и не требует больших финансовых затрат. Не удается завершить лечение ПЭБС данным методом, только в случае пролонгации онкологического заболевания. Поэтому считаем, что выполнение паллиативных ПЭ, по возможности, следует избегать. Метод подходит для лечения ПЭБС в онкохирургической, фтизиохирургической и общехирургической практике. Также может быть применен для лечения постлобэктомических бронхиальных свищей, когда, например, нельзя выполнить итеративную ПЭ из-за низких функциональных показателей (непереносимости ПЭ) или неэффективности других методов лечения. Недостатком комбинированного метода лечения ПЭБС является его длительность, но, учитывая тяжесть патологии и результаты такого лечения, с нашей точки зрения, это вполне приемлемо. Также ранее упоминалось о возможности пролонгации онкологического заболевания на фоне лечения ПЭБС, однако, даже в этом случае применение этого метода помогает пациенту, но лечение не удается завершить: в случае диагностирования пролонгации онкологического заболевания, после ПЭ, развития ПЭБС и применения данного метода с целью его лечения, на любом этапе целесообразно просто продолжать перевязки (после ранее наложенной торакостомы как одного из компонентов метода) и воздерживаться от его других составляющих.
- Сравнивая комбинированный метод лечения ПЭБС с хирургическими методами, следует отметить то, что он как минимум не менее эффективен, но при его использовании отсутствует проблема рецидива свища (при использовании хирургических методов этот показатель составляет 10–20%), нет летальности непосредственно вследствие самого метода лечения (при хирургических методах этот показатель доходит до 18–27%), лечение данным методом можно предложить практически всем больным с данной патологией, в то время как хирургические методы лечения возможно применить лишь у 33,7– 68,7% пациентов [6].
Сравнивая комбинированный метод лечения ПЭБС с использованием септальных окклюдеров при этой патологии, хотим указать, что оба метода безопасны в плане летальности, применимы практически у всех пациентов по общесоматическому статусу, эффективность обоих методов высока, отличия же заключаются в следующем:
- при использовании септальных окклюдеров обязательным является выполнение одного условия: наличие сформировавшегося свища с ригидными краями, что предохраняет от надрыва и дальнейшего расхождения культи бронха во время установки окклюдера [6].Это условие не является обязательным при использовании комбинированного метода (то есть он может применяться у пациентов с неригидными краями свища);
- комбинированный метод значительно длительнее в исполнении по сравнению с использованием септального окклюдера, но полученные при его помощи результаты полного заживления свища надежны у всех пациентов, так как закрытие происходит собственными тканями организма пациента, у части больных, у которых для закрытия ПЭБС был использован септальный окклюдер, возможно длительное просачивание воздуха между краями свища и окклюдером, возможно выпадение окклюдера с рецидивом свища [6, 19] (в таком случае возможно использование комбинированного метода);
- ПЭБС имеют разнообразную форму, поэтому сосудистые окклюдеры вряд ли подойдут для закрытия свищей любой конфигурации;
- учитывая простоту комбинированного метода, для его использования не требуется специальной дорогостоящей аппаратуры и инструментария.
В заключение хотим проиллюстрировать результаты лечения ПЭБС комбинированным методом (рис. 1–8).
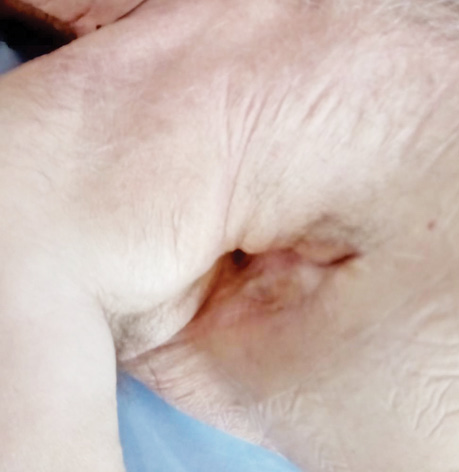
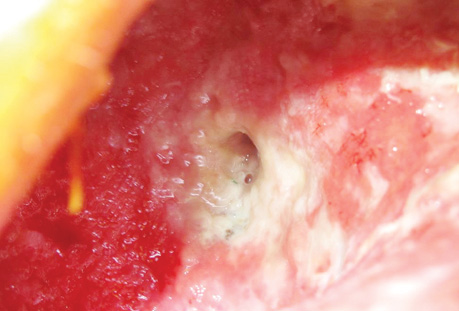
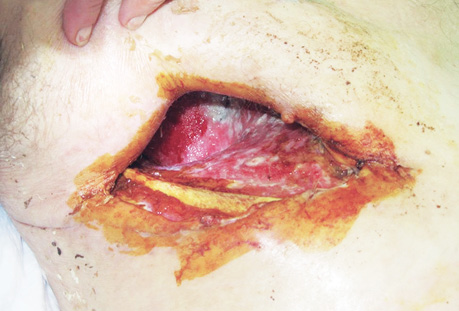
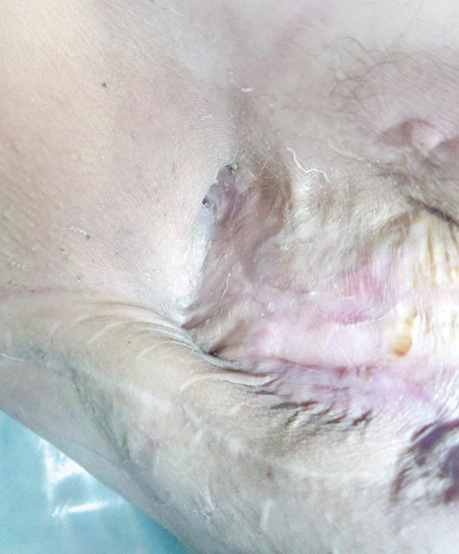
Список использованной литературы
- 1. Шалимов, С.А., Гриневич, Ю.А., & Мясоедов, Д.В. (2008). Справочник по онкологии. Киев: Здоров’я.
- 2. Трахтенберг, А.Х., & Чиссов, В.И. (2009). Рак легкого. Атлас. Москва: ГЭОТАР-Медиа.
- 3. Перельман, М.И., & Корякин, В.А. (1996). Фтизиатрия. Москва: Медицина.
- 4. Чичеватов, Д.А. (2013) Диафрагмальный и сальниковый лоскуты в грудной хирургии. Санкт-Петербург: ЭЛБИ — СПб.
- 5. Hollaus, P. H., Lax, F., El-Nashef, В. B. Hauck, H. H., Lucciarini, P., & Pridun, N. S. (1997). Natural history of bronchopleural fistula after pneumonectomy: a review of 96 cases. The Annals of Thoracic Surgery, 63, 1391–1397. doi: 10.1016/s0003-4975(97)00409-8.
- 6. Мотус, И.Я., Баженов, А.В., Цвиренко, А.С., Басыров, Р.Т., Хольный, П.М., Кардапольцев, Л.В., & Печников, П.П. (2018). Лечение бронхиальных свищей. Выход найден? Хирургия. Журнал им. Н.И. Пирогова, 3-2, 33–38. DOI: 10.17116/hirurgia20183233-38.
- 7. Fruchter, O., Kramer, M.R., Dagan, T., Hatz, R.A., & Lindner, M. (2011). Endobronchial Closure of Bronchopleural Fistulae Using Amplatzer Devices. Chest,139, 682–687. doi: 10.3978/j.issn.2072-1439.2015.08.25.
- 8. Баженов, А.В., Хольный, П.М., Кардапольцев, Л.В., Цвиренко, А.С., Басыров, Р.Т., & Мотус И.Я. (2017). Опыт лечения свища культи правого главного бронха с применением сосудистого окклюдера. Туберкулез и болезни легких, 95(1), 51–55. doi.org/10.21292/2075-1230-2017-95-1-51-55.
- 9. Мотус, И.Я., & Баженов, А.В. (2015). Бронхиальные свищи после пневмонэктомии при раке легкого. Хирургия. Журнал им. Н.И. Пирогова, 8-2, 33–38.
- 10. Колесников, И.С., & Лыткин, М.И. (1988). Хирургия легких и плевры. Ленинград: Медицина.
- 11. Егоров, В.И. (2015). Клеточные технологии в лечении бронхиальных свищей. Здоровье — основа человеческого потенциала: проблемы и пути их решения, 10 (2), 707–708.
- 12. Шулутко, А.М., Овчинников, А.А., Ясногородский, О.О., & Мотус, И.Я. (2006). Эндоскопическая торакальная хирургия. Москва: Медицина.
- 13. Hollaus, P.H., Lax, F., Janakiev, D., Lucciarini, P., Katz, E., Kreuzer, A., & Pridun N.S. (1998). Endoscopic Treatment of Postoperative Bronchopleural Fistula: Experience With 45 Cases. Annals of Thoracic Surgerу,66,923-927. doi: https://doi.org/10.1016/S0003-4975(98)00589-X.
- 14. Котив, В.Н., & Бисенков, Л.Н. (2016). Хирургические инфекции груди и живота. Санкт-Петербург: СпецЛит.
- 15. Гиллер, Д.Б., Кесаев, О.Ш., Короев, В.В., Шилова, М.В., Ратобыльский, Г.В., & Имагожев, Я.Г. (2019). Сложности диагностики и выбора тактики лечения пострезекционной туберкулезной эмпиемы плевры с бронхоплевральным свищем. Российский электронный журнал лучевой диагностики, 9(3), 209–214. doi: 10.21569/2222-7415-2019-9-3-209-214.
- 16. Нематов, О.Н., Сабиров, Ш.Ю., Маюсупов, Ш.Э., Шарипов, А.Б., Холбоев, Э.Н., & Рискиев, А.А. (2015). Трансстернальная, трансмедиастинальная окклюзия главных бронхов в хирургическом лечении послеоперационных бронхиальных свищей у больных туберкулезом органов дыхания. Туберкулез и социально-значимые заболевания, 3, 61–62.
- 17. Egyud, M., & Suzuki, K. J. (2018). Post-resection complications: abscesses, empyemas, bronchopleural fistulas. Journal of Thoracic Disease, 10(28), 3408–3418. doi: 10.21037/jtd.2018.08.48.
- 18. Решетов, А.В., Лазарев, С.М., Волгин, Г.Н., & Симкин, С.М. (2010). Хирургическая профилактика бронхоплевральных свищей после пневмонэктомии. Вестник хирургии им. И.И. Грекова, 169(5), 83–87.
- 19. Akulian, J., Pathak, V., Lessne, M., Hong, K., Feller-Kopman, D., Lee, H., Yarmus, L. (2014). A Novel Approach to Endobronchial Closure of a Bronchial Pleural Fistula. The Annals of Thoracic Surgery, 98(2), 697–699. doi: 10.1016/j.athoracsur.2013.09.105.
Комбінований метод лікування постпневмонектомічних бронхіальних нориць: нове звучання старої проблеми
1Одеський Національний медичний університет
2Одеський обласний клінічний онкологічний диспансер
3Одеська обласна клінічна лікарня
Резюме. Вступ. Пневмонектомія є затребуваною операцією в торакальній хірургії та онкохірургії. Головним хірургічним ускладненням цієї операції є постпневмонектомічна бронхіальна нориця (ПЕБН). Летальність у разі розвитку цього ускладнення є високою, єдиного підходу до лікування немає. Мета. Вивчити ефективність лікування пацієнтів з ПЕБН комбінованим методом, порівняти результати такої терапії з результатами лікування іншими методами. Матеріал і методи. Проведено ретроспективний аналіз результатів консервативного, консервативно-ендоскопічного та комбінованого методів лікування ПЕБН. Залежно від методу лікування пацієнтів було розподілено на 3 групи: пацієнти, яких лікували консервативним методом (n=10), пацієнти, яких лікували консервативно-ендоскопічним методом (n=9) і пацієнти, яких лікували комбінованим методом (n=8). Результати. У першій групі летальність внаслідок ПЕБН і пов’язаних з нею ускладнень становила 70%, осіб, що повністю одужали, не було; у другій групі летальність внаслідок ПЕБН і пов’язаних з нею ускладнень становила 44,5%, видужали 44,5% пацієнтів; у третій групі летальність безпосередньо внаслідок ПЕБН і ускладнень з нею пов’язаних становила 0%, летальність від прогресування онкологічного захворювання на тлі лікування ПЕБН становила 25%, питома вага пацієнтів з повністю ПЕБН, яка повністю зажила, становила 87,5%, повністю завершили лікування 75% пацієнтів. Висновки. Вважаємо, що застосування комбінованого методу лікування ПЕБН дає реальні позитивні результати, значно знижує летальність серед пацієнтів в разі використання його за показаннями, за допомогою цього методу можна вилікувати хворих після невдалого використання інших варіантів лікування ПЕБН.
Ключові слова: комбінований метод лікування постпневмонектомічної бронхіальної нориці; лімфодисекція; пневмонектомія; постпневмонектомічна бронхіальна нориця; рак легені.
Адрес:
Душко Николай Евгеньевич
65055, г. Одеса, ул. Неждановой, 32
Одесский областной онкологический диспансер
Е-mail: ndushko@ukr.net
Correspondence:
Dushko Nikolay Yevgenyevich
32 Nezhdanova str., Odessa 65055
Odessa Regional Oncology Center
Е-mail: ndushko@ukr.net














Leave a comment