Resumos
O fracionamento do extrato metanólico das folhas de Gochnatia barrosii Cabrera (Asteraceae) resultou no isolamento do flavonol glicosídico trans-tilirosídeo [kaempferol 3-O- -D-(6''-O-E-p-cumaroil)-glicopiranosídeo], que nunca tinha sido identificado na referida espécie vegetal. Em teste realizado in vitro, observou-se que tal substância a 500 μg/mL, não tem efeito sobre a mortalidade de juvenis do segundo estágio do nematóide Meloidogyne exigua Goeldi.
Fitoquímico; flavonóide; nematóide
Fractionation of the methanolic extract from Gochnatia barrosii Cabrera (Asteraceae) leaves resulted in the isolation of the flavonol glycoside trans-tiliroside [kaempferol 3-O- -D-(6''-O-E-p-coumaroyl)-glucopyranoside], which had never been found in such plant species. Such substance at 500 μg/mL caused no in vitro effect on the mortality of second-stage juveniles of the nematode Meloidogyne exigua Goeldi.
Phytochemical; flavonoid; nematode
CIÊNCIAS AGRÁRIAS
Purificação do flavonóide trans-tilirosídeo do extrato metanólico das folhas de Gochnatia barrosii Cabrera (asteraceae) e avaliação da sua atividade nematicida
Purification of the flavonoid trans-tiliroside from the methanolic extract of Gochnatia barrosii Cabrera (Asteraceae) leaves and evaluation of the nematicidal activity
Helvécio Martins dos Santos JúniorI; Aline Auxiliadora TirelliI; Hudson Wallace Pereira CarvalhoI; Denilson Ferreira OliveiraII; Ney Robson Taironi do PradoI; Vicente Paulo CamposIII
IUniversidade Federal de Lavras/UFLA - Departamento de Química/DQI - Lavras, MG
IIUniversidade Federal de Lavras/UFLA - Departamento de Química/DQI - Cx. P. 3037 - 37200-000 - Lavras, MG - denilson@dqi.ufla.br IIIUniversidade Federal de Lavras/UFLA - Departamento de Fitopatologia/DFP - Lavras, MG
RESUMO
O fracionamento do extrato metanólico das folhas de Gochnatia barrosii Cabrera (Asteraceae) resultou no isolamento do flavonol glicosídico trans-tilirosídeo [kaempferol 3-O- -D-(6''-O-E-p-cumaroil)-glicopiranosídeo], que nunca tinha sido identificado na referida espécie vegetal. Em teste realizado in vitro, observou-se que tal substância a 500 μg/mL, não tem efeito sobre a mortalidade de juvenis do segundo estágio do nematóide Meloidogyne exigua Goeldi.
Termos para indexação: Fitoquímico, flavonóide, nematóide.
ABSTRACT
Fractionation of the methanolic extract from Gochnatia barrosii Cabrera (Asteraceae) leaves resulted in the isolation of the flavonol glycoside trans-tiliroside [kaempferol 3-O- -D-(6''-O-E-p-coumaroyl)-glucopyranoside], which had never been found in such plant species. Such substance at 500 μg/mL caused no in vitro effect on the mortality of second-stage juveniles of the nematode Meloidogyne exigua Goeldi.
Index terms: Phytochemical, flavonoid, nematode.
INTRODUÇÃO
O café é uma das mais importantes culturas no Brasil, que é o responsável por cerca de 25% da produção mundial desta commodity. Muitos esforços têm sido feitos para aumentar a produtividade do setor, que é notadamente sensível aos problemas fitossanitários (Guerreiro Filho, 2006). Dentre eles, destaca-se o fitonematóide Meloidogyne exigua Goeldi, 1887, que é bastante disseminado nos cafezais brasileiros (Campos & Melles, 1987; Campos & Villain, 2005) e pode causar perdas de produtividade que chegam a 45% (Barbosa et al., 2004). Em amostras de solo e de raízes coletadas em cafezais de Minas Gerais foi detectada a presença desse nematóide em 45,4% das análises realizadas (Souza et al., 1999). Mais recentemente, Portz et al. (2006) observaram a presença de M. exigua em 36,5% das amostras coletadas em municípios do oeste do Paraná.
O controle de nematóides em cafeeiros é geralmente realizado com produtos químicos sintéticos que, além de apresentarem problemas de eficiência, acarretam a contaminação do ambiente e do solo com substâncias de elevada toxicidade e a destruição de organismos benéficos ao cafeeiro. Uma das possíveis alternativas para contornar tais problemas consiste no emprego de produtos naturais, que têm sido fontes de compostos para o manejo de pragas e doenças (Jespers & Waard, 1993; Isman, 2000; Oliveira et al., 2007a;Oliveira et al., 2008; Amaral et al., 2009). Dentre tais produtos podem ser citados os de origem vegetal (Roel et al., 2000), nos quais são encontradas diversas classes de substâncias com efeito fitonematicida (Datta & Saxena, 2001; San Martin & Magunacelaya, 2005; Pastor de Abram & Zelada Mariluz, 2006; Oliveira et al., 2007b; Begum et al., 2008; Thoden et al., 2009) e, dentre elas, os flavonóides (Begum et al., 2000; Wuyts et al., 2006; El Allagui et al., 2007; Jones et al., 2007; Adekunle & Aderogba, 2008; Shakil et al., 2008).
Apesar do grande potencial das espécies vegetais para a produção de substâncias de importância biológica para a nossa sociedade, várias delas ainda não foram submetidas a estudos para avaliar suas possibilidades de utilização no manejo de doenças de importância agronômica. Um exemplo é a espécie Gochnatia barrosii Cabrera, pertencente à família Asteraceae. Trata-se de um subarbusto que cresce em regiões de cerrado do Brasil e que, assim como várias outras espécies do gênero, é popularmente conhecida como cambará (Corrêa, 1984; Carvalho, 1992; Gomes et al., 2004). Com vistas a contribuir para o estudo de tal planta, buscou-se isolar e identificar flavonóides presentes na fração solúvel em metanol do extrato de G. barrosii, para que os mesmos pudessem ser submetidos à avaliação da atividade contra M. exigua.
MATERIAL E MÉTODOS
Procedimentos gerais
Utilizou-se metanol (MeOH) e ácido acético (AcOH) de grau UV-HPLC (Vetec, Brasil), enquanto os demais solventes foram de grau analítico. Empregou-se água (H2O) ultrapura do tipo I, 18 Ωm (Milli-Q®; Millipore). As análises em cromatógrafo líquido de alta eficiência (CLAE) foram realizadas em aparelho Varian, com detector de UV-Vis, modelo ProStar 310, bomba ternária modelo ProStar 230, injetor manual; e aparelho Shimadzu CLASS-LC10 com detector de UV-Vis do tipo DAD modelo SPD-10Ai, equipado com três bombas modelo LC10A, injetor automático, modelo LC10 AutoSampler. Em ambos os casos, empregou-se coluna de fase reversa de sílica-C18 Phenomenex Luna® (5mm, 250 x 4,6 mm). Os fracionamentos em CLAE foram feitos em aparelho Varian, equipado com duas bombas modelo PrepStar SD1, com detector de UV-Vis modelo ProStar 320 a 256 nm, injetor manual e coluna preparativa de fase reversa de sílica-C18 Phenomenex Luna® (10 μm, 250 x 21,2 mm). As análises por ressonância magnética nuclear (RMN) foram realizadas em espectrômetro Varian Inova 500, operando a 500 MHz para hidrogênio (1H) e 126 MHz para carbono treze (13C). Para tanto, dissolveram-se as amostras em dimetilsulfóxido hexadeuterado (DMSO-d6), cujo sinal foi empregado como referência.
Material vegetal
Folhas de vários indivíduos de G. barrosii foram coletadas em campos rupestres da serra da Bocaina, localizada no sul do estado de Minas Gerais, em janeiro de 2006, e levadas ao Laboratório de Produtos Naturais, do Departamento de Química (DQI), da Universidade Federal de Lavras (UFLA), no qual teve início o processo de purificação. Uma amostra foi encaminhada ao Departamento de Biologia (DBI) da UFLA para identificação botânica e uma exsicata foi depositada no Herbário ESAL (ESAL 6448).
Preparo e fracionamento do extrato vegetal
As folhas foram secas a 40° C em estufa com ventilação e renovação de ar. Em seguida, o material vegetal (286 g) foi triturado em moinho e submetido a extração exaustiva com MeOH a frio (8 x 1000 mL). O extrato obtido foi seco sob pressão reduzida em evaporador rotatório e liofilizado, resultando em resíduo verde escuro (10,4 g). Esse foi sucessivamente lavado com hexano (Hex; 6 x 100 mL), acetato de etila (AcOEt; 6 x 100 mL) e MeOH (6 x 100 mL). Após remoção dos solventes sob pressão reduzida, obtiveram-se três frações: solúvel em Hex (2,3 g), em AcOEt (0,3 g) e em MeOH (6,7 g). Parte da fração solúvel em MeOH (5,0 g) foi fracionada por cromatografia em coluna de 4 x10 cm de resina Amberlite XAD-16 (Sigma), empregando-se H2O (400 mL), H2O/MeOH (80:20, 400 mL; 60:40, 400 mL; 40:60, 400 mL; 20:80, 400 mL), MeOH (400 mL) e AcOEt (400 mL) como fases móveis. As sete frações obtidas foram analisadas em CLAE (gradiente de H2O/MeOH 95:5 a 0:100 em 40 minutos; 100% de MeOH de 40 a 55 minutos; fluxo de 1mL/min) e RMN 1H. As frações semelhantes eluídas com H2O/MeOH (40:60 e 20:80) e MeOH foram combinadas e concentradas, resultando na obtenção de um resíduo sólido (2,2 g), do qual se retirou aproximadamente metade (1,1 g) para ser eluída com H2O/MeOH (50:50, 50 mL; 5:95, 50 mL) através de cartucho com 1,0 cm de diâmetro interno e 10 g de sílica-C18. Após análises das frações obtidas em CLAE (gradiente de H2O/MeOH 95:5 a 0:100 em 40 minutos; 100% de MeOH de 40 a 55 minutos; fluxo de 1mL/min) e RMN 1H, removeram-se os solventes em evaporador rotatório e liofilizadora e se submeteu aquela eluída com H2O/MeOH (5:95; 120 mg) a fracionamento em CLAE por eluição isocrática com AcOH/H2O/MeOH (0,5:54,5:45,0) a 16 mL/min. Obtiveram-se cinco frações, que foram analisadas em CLAE [eluição isocrática com AcOH/H2O/MeOH (0,5:54,5:45,0) e fluxo de 1 mL/min]. Após a remoção dos solventes, uma alíquota de 1,0 mg da fração 2 (trans-tilirosídeo; tempo de retenção: 34,3 - 39,2 min; 20 mg) foi solubilizada em 2 mL de MeOH para ser inserida em espectrômetro de massas (EM) Agilent 1100 LC/MS Trap, através de uma interface do tipo electrospray ionization (ESI). Obtiveram-se espectros no modo positivo e negativo. Outra parte (10 mg) da fração 2 foi analisada por RMN de 1H, 13C, distortionless enhancement by polarization transfer (DEPT 90° e 135°), gradient heteronuclear multiple quantum coherence (1H-13C gHMQC; 1JC-H: correlações heteronucleares 1H x 13C a curta distância), gradient heteronuclear multiple bond coherence (1H-13C gHMBC; 2,3JC-H: correlações heteronucleares 1H x 13C a longa distância) e gradient correlated spectroscopy (1H-1H gCOSY: correlações homonucleares 1H x 1H).
Teste in vitro de mortalidade
Seguindo a técnica de Hussey & Barker (1973), modificada por Boneti & Ferraz (1981), extraíram-se ovos das raízes de cafeeiros (Coffea arabica L.) infectados com M. exigua, para serem purificados pela técnica de Coolen & Herde (1972). A seguir, montaram-se câmaras de eclosão com os referidos ovos, o que permitiu obter juvenis de segundo estágio (J2) com menos de dois dias após a eclosão, para serem empregados nos testes realizados conforme descrito por Amaral et al. (2003), com algumas modificações. Em cada cavidade de uma placa de polipropileno (PP) com 96 cavidades de 300 μL, foram colocados 20 μL de uma suspensão aquosa contendo entre 20 e 30 J2 e 100 μL da amostra a ser avaliada. O trans-tilirosídeo (fração 2) foi solubilizado em solução aquosa de Tween 80 a 1% (g/mL) de forma a se obter uma concentração final de 500 μg/mL na cavidade da placa. O experimento foi conduzido em câmara climatizada do tipo B.O.D. (28±0,3° C, sem a presença de luz). Após 48 h, uma gota de solução aquosa de hidróxido de sódio a 1,0 M foi adicionada ao conteúdo de cada cavidade e contaram-se os nematóides. Aqueles retos e imóveis foram considerados mortos, enquanto os retorcidos ou móveis foram considerados vivos. Empregaram-se quatro repetições por tratamento, tendo Tween 80 a 1% (g/mL) e aldicarbe a 50 μg/mL (Temik® 150, Rhône-Poulenc AgroBrasil Ltda) como controle negativo e positivo, respectivamente.
Análise estatística
Os dados dos testes foram convertidos em porcentagem e submetidos à análise de variância (ANAVA), por meio do software Sistema para Análise de Variância - SISVAR (Ferreira, 2000). As médias foram comparadas segundo o teste de Scott & Knott (1974), a 5% de significância.
RESULTADOS E DISCUSSÃO
O rendimento da produção de extrato foi de 3,6% em relação à massa seca das folhas de G. barrosii, o que está coerente com os rendimentos observados para outras espécies vegetais (Castilho & Kaplan, 2008). Ao se submeter o referido extrato à lavagem com solventes, obtiveram-se três frações distintas, dentre as quais optou-se pela utilização daquela solúvel em MeOH, na qual deveria estar a maioria dos flavonóides, segundo dados descritos para outras espécies vegetais (Gobbo-Neto & Lopes, 2008). Ao ser eluída através de coluna de Amberlite XAD, a fração solúvel em MeOH deu origem a sete frações, cujos cromatogramas obtidos em CLAE permitiram agrupar as frações eluídas em H2O/MeOH (40:60, 20:80) e MeOH, por similaridade. Já as análises em RMN 1H permitiram obter o perfil químico das frações eluídas em XAD, indicando a presença de açúcares nas três primeiras frações pela presença de sinais entre δH 5,1-2,4, característicos de hidrogênios de açúcares. As quatro últimas frações apresentavam sinais entre δH 8,2-6,0 e H 5,6-3,0 sugerindo a presença de sistemas aromáticos conectados a açúcares (Markham & Geiger, 1994). Optou-se por dar continuidade ao trabalho com as três frações agrupadas [H2O/MeOH (40:60, 20:80) e MeOH], pela presença de flavonóides sugerida nas análises em RMN 1H. O fracionamento seguinte, em cartucho de sílica-C18, deu origem a duas novas frações, dentre as quais apenas aquela eluída H2O/MeOH (5:95) apresentava flavonóides segundo análises por RMN 1H. Logo, tal fração foi submetida a novo fracionamento em CLAE, o que resultou na obtenção da fração 2 pura, que se tratava de um pó amarelo amorfo. O espectro de RMN 1H exibia sinais na região de hidrogênios aromáticos com padrão de substituição característico do flavonol kaempferol : δH 6,35 (1H; d, J=2,0 Hz; H-8), δH 6,12 (1H; d, J=2,0 Hz; H-6), δH 7,97 (2H; d, J=8,9 Hz; H-2' e H-6') e δH 6,84 (2H; d, J=8,9 Hz; H-3' e H-5') (Tabela 1) (Budzianowski & Skrzypczak, 1995).
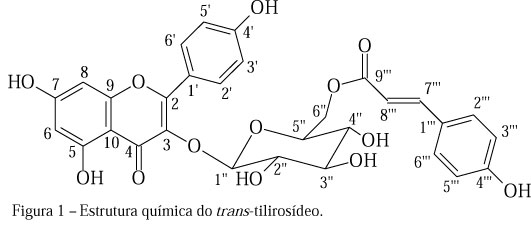
O conjunto de sinais entre δH 3,16 e δH 5,43 foi atribuído aos hidrogênios ligados a átomos de carbono de açúcares, sendo aquele em δH 5,43 (H-1''), característico de hidrogênio anomérico. O sinal em δH 5,43 (1H; d, J=7,5 Hz; H-1''), com uma constante de acoplamento (7,5 Hz) característica de acoplamento trans-diaxial, juntamente com dados da literatura (Budzianowski & Skrzypczak, 1995), permitiram identificar o resíduo de açúcar como sendo a glicose na forma β-D-glicopiranosídica. Foi possível ainda evidenciar a presença de um resíduo do ácido p-cumárico através dos sinais característicos da dupla ligação em configuração trans, δH 7,33 (1H; d, J=16,0 Hz; H-7''') e δH 6,09 (1H; d, J=16,0 Hz; H-8'''), que ficou nítida pela elevada constante de acoplamento (Lencina et al., 2001). A presença do referido resíduo também foi percebida pelas absorções em δH 7,35 (2H; d, J=8,5 Hz; H-2''' e H-6''') e δH 6,77 (2H; d, J=8,5 Hz; H-3''' e H-5'''), que são características de hidrogênios do anel, em posição orto (Lencina et al., 2001). A ligação do ácido p-cumárico à glicose, formando uma função éster no carbono C-6'', foi confirmada através das correlações a três ligações (3JC-H) observadas no mapa de contorno gHMBC entre o carbono C-9''' ( δc 166,2) e os hidrogênios H-6''A ( δH 4,27) e H-6''B ( δH 4,02), além das absorções do açúcar, especialmente do carbono C-5'' ( δc 74,1) e C-6'' ( δc 62,9), que se encontram, respectivamente, 3,1 ppm em campo mais alto e 1,9 ppm em campo mais baixo em relação ao kaempferol 3-O- β-D-glicopiranosídeo (Agrawall, 1989; Lencina et al., 2001). Já a correlação 3JC-H entre o carbono C-3 ( δc 132,9) e o hidrogênio anomérico em δH 5,43 (H-1'') observada no gHMBC permitiu confirmar a ligação da unidade glicosídica ao carbono C-3 do kaempferol. Nos espectros de RMN 13C e DEPT (90° e 135°), observou-se a presença de vinte e seis sinais, sendo treze atribuídos à unidade flavonoídica, sete à unidade p-cumaroil e seis à unidade glicosídica (Tabela 1). Assim como no caso dos espectros de RMN de 1H, havia a indicação da presença de um flavonol 5,7,4'-triidroxilado (kaempferol), com um açúcar ligado ao carbono C-3 (Lencina et al., 2001). Desse modo, análises detalhadas dos mapas de contorno dos experimentos gHMQC, gHMBC e gCOSY permitiram um refinamento da proposta inicial, o que resultou na atribuição da estrutura do flavonol glicosídico kaempferol 3-O-β-D-(6''-O-E-p-cumaroil)-glicopiranosídeo, também conhecido como trans-tilirosídeo (Figura 1), à substância isolada, em total conformidade com os dados obtidos por Budzianowski & Skrzypczak (1995) (Tabela 1).
A estrutura proposta através de experimentos de RMN (C30H26O13, 594 u), foi confirmada por ESI-EM, que forneceu valores idênticos aos anteriormente relatados para essa substância: m/z 593 u [M - H]- e m/z 617 u [M + Na]+ nos modos negativo e positivo, respectivamente (Lencina et al., 2001; Gobbo-Neto & Lopes, 2008).
Os flavonóides em geral apresentam considerável potencial para emprego no controle de pragas agrícolas. Para exemplificar é possível mencionar o trabalho de Onyilagha et al. (2004), que avaliaram o efeito de trinta e sete flavonóides na preferência alimentar e desenvolvimento larval de Mamestra configurata Walker (Lepidoptera: Noctuidae), observando atividade para diversos deles. Outro exemplo é o trabalho de Gallo et al. (2006), que avaliaram a bioatividade de extratos e compostos isolados de Vitex polygama Cham. (Verbenaceae) e Siphoneugena densiflora O. Berg (Myrtaceae), contra Spodoptera frugiperda (J.E. Smith) (Lepidoptera: Noctuidae), sendo que, dentre os compostos isolados, os flavonóides foram os que apresentaram melhor atividade inseticida. Shakil et al. (2008) relataram o isolamento e, identificação de dois novos flavonóides prenilados de Phyllanthus niruri L. (Phyllanthaceae), a popular quebra-pedra, com atividade nematicida contra Meloidogyne incognita (Kofoid & White) Chitwood e Rotylenchulus reniformis (Linford & Oliveira), sendo que um dos compostos, 2-(4-hidroxifenil)-8-(3-metilbut-2-enil)-croman-4-ona, apresentou atividade contra R. reniformis semelhante ao nematicida carbofuran (CL50 3,3 e 3,1 g/mL, respectivamente). Beninger & Abou-Zaid (1997) verificaram que uma fração rica no trans-tilirosídeo obtida do extrato etanólico de Pinus banksiana Lamb. (Pinaceae) diminuiu o crescimento e aumentou a mortalidade de lagartas de segundo instar de Lymantria dispar L. (Lepidoptera: Lymantriidae), inseto causador de severas desfolhas de florestas localizadas no leste dos Estados Unidos e Canadá. Entretanto, no presente trabalho, o trans-tilirosídeo não se mostrou ativo no teste de mortalidade contra J2 de M. exigua.
CONCLUSÕES
Das folhas de Gochnatia barrosii, espécie vegetal sobre a qual não há pesquisas quanto a sua composição química, isolou-se o flavonol glicosídico trans-tilirosídeo. No teste de mortalidade de J2 do fitonematóide Meloidogyne exigua, nenhum efeito foi observado para tal substância.
AGRADECIMENTOS
À Fundação de Amparo à Pesquisa do Estado de Minas Gerais (FAPEMIG), ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) e à Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES), pelo suporte financeiro e concessão de bolsas.
(Recebido em 19 de setembro de 2008 e aprovado em 13 de julho de 2009)
- ADEKUNLE, O.K.; ADEROGBA, M.A. Characterisation of an antinematicidal compound from Leucaena leucocephala Australasian Plant Disease Notes, Toowoomba, v.3, n.1, p.168-170, 2008.
- AGRAWALL, P.K. Carbon-13 NMR of flavonoids. New York: Elsevier, 1989. 564p.
- AMARAL, D. R.; OLIVEIRA, D. F.; CAMPOS, V. P.; PANTALEÃO, J. A.; CARVALHO, D. A. de; NUNES, A. da S. Effect of plant and fungous metabolites on Meloidogyne exigua Ciência e Agrotecnologia, Lavras, v. 33, Edição Especial, p. 1861-1865, 2009.
- AMARAL, D.R.; OLIVEIRA, F.E.R.; OLIVEIRA, D.F. Purification of two substances from bulbs of onion with nematicidal activity against Meloidogyne exigua Goeldi. Nematology, Leiden, v.5, n.6, p.859-864, 2003.
- BARBOSA, D.H.S.G.; VIEIRA, H.D.; SOUZA, R.M.; VIANA, A.P.; SILVA, C.P. Field estimates of coffee yield losses and damage threshold by Meloidogyne exigua Nematologia Brasileira, Piracicaba, v.28, n.1, p.49-54, 2004.
- BEGUM, S.; WAHAB, A.; SIDDIQUI, B.S.; QAMAR, F. Nematicidal constituents of the aerial parts of Lantana camara Journal of Natural Products, Washington, v.63, n.6, p.765-767, 2000.
- BEGUM, S.; ZEHRA, S.Q.; SIDDIQUI, B.S.; FAYYAZ, S.; RAMZAN, M. Pentacyclic triterpenoids from the aerial parts of Lantana camara and their nematicidal activity. Chemistry & Biodiversity, Weinheim, v.5, n.9, p.1856-1866, 2008.
- BENINGER, C.W.; ABOU-ZAID, M.M. Flavonol glycosides from four pine species that inhibit early instar gypsy moth (Lepidoptera: Lymantriidae) development. Biochemical Systematics and Ecology, Oxford, v.25, n.6, p.505-512, 1997.
- BONETI, J.I.S.; FERRAZ, S. Modificação do método de Hussey & Barker para extração de ovos de Meloidogyne exigua em raízes de cafeeiro. Fitopatologia Brasileira, Brasília, v.6, n.3, p.553-561, 1981.
- BUDZIANOWSKI, J.; SKRZYPCZAK, L. Phenylpropanoid esters from Lamium album flowers. Phytochemistry, Oxford, v.38, n.4, p.997-1001, 1995.
- CAMPOS, V.P.; MELLES, C.C.A. Ocorrência e distribuição de espécies de Meloidogyne em cafezais dos campos das vertentes do sul de Minas Gerais. Nematologia Brasileira, Piracicaba, v.11, p.233-241, 1987.
- CAMPOS, V.P.; VILLAIN, L. Nematode parasites of coffee and cocoa. In: LUC, M.; SIKORA, R.A.; BRIDGE, J. (Eds.). Plant parasitic nematodes in subtropical and tropical agriculture. 2.ed. London: CAB International, 2005. p.529-579.
- CARVALHO, D.A. Flora fanerogâmica de campos rupestres da serra da Bocaina, Minas Gerais: caracterização e lista de espécies. Ciência e Prática, Lavras, v.16, n.1, p.97-122, 1992.
- CASTILHO, R.O.; KAPLAN, M.A.C. Constituintes químicos de Licania tomentosa Benth. (Chrysobalanaceae). Química Nova, São Paulo, v.31, n.1, p.66-69, 2008.
- COOLEN, W.A.; HERDE, C.J. d'. A method for the quantitative extraction of nematodes from plant tissue. Merelbeke: Ghent State Agriculture Research Center, 1972. 77p.
- CORRÊA, M.P. Dicionário das plantas úteis do Brasil e das exóticas cultivadas 2.ed. Rio de Janeiro: Ministério da Agricultura/IBDF, 1984. 6v.
- DATTA, S.; SAXENA, D.B. Pesticidal properties of parthenin (from Parthenium hysterophorus) and related compounds. Pest Management Science, Chichester, v.57, n.1, p.95-101, 2001.
- EL ALLAGUI, N.; TAHROUCH, S.; BOURIJATE, M.; HATIMI, A. Action of different plant extracts on mortality of root-knot nematodes of genus Meloidogyne Acta Botanica Gallica, Lille, v.154, n.4, p.503-509, 2007.
- FERREIRA, D.F. Análise estatística por meio do SISVAR (Sistema para Análise de Variância) para Windows versão 4.0. In: REUNIÃO ANUAL DA REGIÃO BRASILEIRA DA SOCIEDADE INTERNACIONAL DE BIOMETRIA, 45., 2000, São Carlos. Anais.. São Carlos: UFSCar, 2000. p.255-258.
- GALLO, M.B.C.; ROCHA, W.C.; CUNHA, U.S. da; DIOGO, F.A.; SILVA, F.C. da; VIEIRA, P.C.; VENDRAMIM, J.D.; FERNANDES, J.B.; SILVA, M.F.G.F. da; PEREIRA, L.G.B. Bioactivity of extracts and isolated compounds from Vitex polygama (Verbenaceae) and Siphoneugena densiflora (Myrtaceae) against Spodoptera frugiperda (Lepidoptera: Noctuidae). Pest Management Science, Chichester, v.62, n.11, p.1072-1081, 2006.
- GOBBO-NETO, L.; LOPES, N.P. Online identification of chlorogenic acids, sesquiterpene lactones, and flavonoids in the Brazilian arnica Lychnophora ericoides Mart. (Asteraceae) leaves by HPLC-DAD-MS and HPLC-DAD-MS/MS and a validated HPLC-DAD method for their simultaneous analysis. Journal of Agricultural and Food Chemistry, Washington, v.56, n.4, p.1193-1204, 2008.
- GOMES, B.Z.; MARTINS, F.R.; TAMASHIRO, J.Y. Estrutura do cerradão e da transição entre cerradão e floresta paludícola num fragmento da International Paper do Brasil Ltda., em Brotas, SP. Revista Brasileira de Botânica, São Paulo, v.27, n.2, p.249-262, 2004.
- GUERREIRO FILHO, O. Coffee leaf miner resistance. Brazilian Journal of Plant Physiology, Campinas, v.18, n.1, p.109-117, 2006.
- HUSSEY, R.S.; BARKER, K.R.A. Comparison of methods for collecting inocula of Meloidogyne spp. including a new technique. Plant Disease Reporter, Beltsville, v.57, n.12, p.1025-1028, 1973.
- ISMAN, M.B. Plant essential oils for pest and disease management. Crop Protection, Oxford, v.19, n.8/10, p.603-608, 2000.
- JESPERS, A.B.K.; WAARD, M.A. de. Natural products in plant protection. Netherlands Journal of Plant Pathology, Wageningen, v.99, n.3, p.109-117, 1993. Supplement.
- JONES, J.T.; FURLANETTO, C.; PHILLIPS, M.S. The role of flavonoids produced in response to cyst nematode infection of Arabidopsis thaliana Nematology, Leiden, v.9, n.5, p.671-677, 2007.
- LENCINA, C.; PIRES, V.S.; GOSMANN, G.; TAKETA, A.T.C.; SCHENKEL, E.P. Tilirosídeo em Croton gnaphalii BAILL. Revista Brasileira de Farmacognosia, João Pessoa, v.11, n.2, p.89-93, 2001.
- MARKHAM, K.R.; GEIGER, H. 1H nuclear magnetic resonance spectroscopy of flavonoids and their glycosides in hexadeuterodimethylsulfoxide. In: HARBORNE, J.B. (Ed.). The Flavonoids: advances in research since 1986. London: Chapman & Hall, 1994. p.441-498.
- OLIVEIRA, D.F.; CAMPOS, V.P.; AMARAL, D.R.; NUNES, A.S.; PANTALEÃO, J.A.; COSTA, D.A. Selection of rhizobacteria able to produce metabolites active against Meloidogyne exigua European Journal of Plant Pathology, Dordrecht, v.119, n.4, p.477-479, 2007a.
- OLIVEIRA, D.F.; CARVALHO, H.W.P. de; NUNES, A.S.; SILVA, G.H.; CAVALHEIRO, A.J.; CAMPOS, V.P. Atividade de carboidrato purificado a partir da cebola (Allium cepa L.) e de carboidratos comerciais sobre juvenis de Meloidogyne exigua Goeldi. Nematologia Brasileira, Piracicaba, v.31, p.202-209, 2007b.
- ONYILAGHA, J.C.; LAZORKO, J.; GRUBER, M.Y.; SOROKA, J.J.; ERLANDSON, M.A. Effect of flavonoids on feeding preference and development of the crucifer pest Mamestra configurata Walker. Journal of Chemical Ecology, New York, v.30, n.1, p.109-124, 2004.
- PASTOR DE ABRAM, A.; ZELADA MARILUZ, B.R. Phytochemical study of Flaveria bidentis (L.) Kuntze (Asteraceae). Revista de la Sociedad Química del Perú, Lima, v.72, n.1, p.3-11, 2006.
- PORTZ, R.L.; STANGARLIN, J.R.; FRANZENER, G.; BALCI-PEÑA, M.I.; FURLANETTO, C. Meloidogyne spp. associadas à cafeicultura em municípios do oeste do Paraná. Nematologia Brasileira, Piracicaba, v.30, n.1, p.23-27, 2006.
- ROEL, A.R.; VENDRAMIM, J.D.; FRIGHETTO, R.T.S.; FRIGHETTO, N. Efeito do extrato acetato de etila de Trichilia pallida Swartz (Meliaceae) no desenvolvimento e sobrevivência da lagarta-do-cartucho. Bragantia, Campinas, v.59, n.1, p.53-58, 2000.
- SAN MARTIN, R.; MAGUNACELAYA, J.C. Control of plant-parasitic nematodes with extracts of Quillaja saponaria Nematology, Leiden, v.7, n.4, p.577-585, 2005.
- SCOTT, A.J.; KNOTT, M.A. A cluster analyses method for grouping means in the analyses of variance. Biometrics, Washington, v.30, n.3, p.502-512, 1974.
- SHAKIL, N.A.; PANKA, J.; KUMAR, J.; PANDEY, R.K.; SAXENA, D.B. Nematicidal prenylated flavanones from Phyllanthus niruri Phytochemistry, Oxford, v.69, n.3, p.759-764, 2008.
- SILVA, P. A.; OLIVEIRA, D. F.; PRADO, N. R. T. do; CARVALHO, D. A. de; CARVALHO, G. A. de. Evaluation of the antifungal activity by plant extracts activity against Colletotrichum gloeosporioides Penz. Ciência e Agrotecnologia, Lavras, v. 32, n. 2, p. 420-428, mar./abr., 2008.
- SOUZA, J.T.; MAXIMINIANO, C.; CAMPOS, V.P. Nematóides parasitos encontrados em cafeeiros em campo e em viveiros de mudas do Estado de Minas Gerais. Summa Phytopathologica, Botucatu, v.25, n.1, p.180-183, 1999.
- THODEN, T.C.; HALLMANN, J.; BOPPRE, M. Effects of plants containing pyrrolizidine alkaloids on the northern root-knot nematode Meloidogyne hapla European Journal of Plant Pathology, Dordrecht, v.123, n.1, p.27-36, 2009.
- WUYTS, N.; SWENNEN, R.; WAELE, D. de. Effects of plant phenylpropanoid pathway products and selected terpenoids and alkaloids on the behavior of the plant-parasitic nematodes Radopholus similis, Pratylenchus penetrans and Meloidogyne incognita Nematology, Leiden, v.8, n.1, p.89-101, 2006.
Datas de Publicação
-
Publicação nesta coleção
29 Nov 2010 -
Data do Fascículo
Out 2010
Histórico
-
Recebido
19 Set 2008 -
Aceito
13 Jul 2009