Resumos
O objetivo deste trabalho foi avaliar a contaminação e o potencial para síntese de aflatoxinas pelos isolados do grupo Aspergillus flavus em grãos armazenados de amendoim (Arachis hypogaea L.), que foram produzidos com distintos procedimentos de calagem, de colheita e de secagem. Para isto, foram avaliadas doze amostras de grãos de amendoim, cv. Botutatu, provenientes de plantas cultivadas em área que recebeu ou não a aplicação de calcário, colhidas aos 104, 114 e 124 dias após a semeadura e secas em condições ambientais e em estufa. Aos 12 e 18 meses de armazenamento, os grãos foram tratados com hipoclorito de sódio e incubados em BDA, a 20°C, por cinco dias. As espécies do grupo Aspergillus flavus foram identificadas após incubação em meio ADM. Posteriormente, o potencial toxígeno foi avaliado pelo método da cromatografia de camada delgada. A análise da freqüência de fungos revelou que os grãos de amendoim armazenados estavam contaminados por Aspergillus spp., Penicillium spp. e Fusarium spp. Os grãos de amendoim, provenientes da colheita antecipada, apresentaram maior contaminação pelo grupo Aspergillus flavus, sendo menor a proporção destes com potencial toxígeno.
micotoxinas; contaminação; potencial toxígeno; teste de sanidade
The objective of this work was to evaluate the effect of the storage on the potential of aflatoxin production by isolates from Aspergillus flavus group in peanut (Arachis hypogaea L.). These kernels were obtained from a field experiment with two areas (with or without lime), three times of harvest (104, 114 and 124 days after planting) and two types of dryer conditions (ambient and chamber with forced air). After 12 and 18 months of storage, the kernels were treated with sodium hypochloride and incubated in a PDA at 20°C during five days. The isolates from Aspergillus flavus group were identified after incubation in ADM culture medium. The toxigenic potential was analyzed by thin layer chromatography. The genera detected were Aspergillus, Penicillium and Fusarium. The kernels from the first harvest, showed higher contamination by the Aspergillus flavus group, but the small proportion with toxigen potential.
micotoxin; contamination; toxigenic potential; health test
ARTIGOS CIENTÍFICOS
FITOTECNIA
Influência da calagem, da época de colheita e da secagem na incidência de fungos e aflatoxinas em grãos de amendoim armazenados
Storage peanut kernels fungal contamination and aflatoxin as affected by liming, harvest time and drying
Claudia Antonia Vieira RossettoI; Otniel Freitas SilvaII; Antonio Edílson da Silva AraújoIII
IEngenheiro Agrônomo, Doutor, Universidade Federal Rural do Rio de Janeiro (UFRRJ), Instituto de Agronomia, Departamento de Fitotecnia, CP 74511, 23890-000, Rio de Janeiro, RJ, E-mail: cavrosse@ufrrj.br, com bolsa de PQ do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq)
IIEngenheiro Agrônomo, Mestre, Empresa Brasileira de Pesquisa Agropecuária (EMBRAPA), Centro Nacional de Tecnologia Agroindustrial de Alimentos
IIIMestrando em Fitotecnia, UFRRJ, com bolsa do CNPq
RESUMO
O objetivo deste trabalho foi avaliar a contaminação e o potencial para síntese de aflatoxinas pelos isolados do grupo Aspergillus flavus em grãos armazenados de amendoim (Arachis hypogaea L.), que foram produzidos com distintos procedimentos de calagem, de colheita e de secagem. Para isto, foram avaliadas doze amostras de grãos de amendoim, cv. Botutatu, provenientes de plantas cultivadas em área que recebeu ou não a aplicação de calcário, colhidas aos 104, 114 e 124 dias após a semeadura e secas em condições ambientais e em estufa. Aos 12 e 18 meses de armazenamento, os grãos foram tratados com hipoclorito de sódio e incubados em BDA, a 20°C, por cinco dias. As espécies do grupo Aspergillus flavus foram identificadas após incubação em meio ADM. Posteriormente, o potencial toxígeno foi avaliado pelo método da cromatografia de camada delgada. A análise da freqüência de fungos revelou que os grãos de amendoim armazenados estavam contaminados por Aspergillus spp., Penicillium spp. e Fusarium spp. Os grãos de amendoim, provenientes da colheita antecipada, apresentaram maior contaminação pelo grupo Aspergillus flavus, sendo menor a proporção destes com potencial toxígeno.
Palavras-chave: micotoxinas, contaminação, potencial toxígeno, teste de sanidade.
ABSTRACT
The objective of this work was to evaluate the effect of the storage on the potential of aflatoxin production by isolates from Aspergillus flavus group in peanut (Arachis hypogaea L.). These kernels were obtained from a field experiment with two areas (with or without lime), three times of harvest (104, 114 and 124 days after planting) and two types of dryer conditions (ambient and chamber with forced air). After 12 and 18 months of storage, the kernels were treated with sodium hypochloride and incubated in a PDA at 20°C during five days. The isolates from Aspergillus flavus group were identified after incubation in ADM culture medium. The toxigenic potential was analyzed by thin layer chromatography. The genera detected were Aspergillus, Penicillium and Fusarium. The kernels from the first harvest, showed higher contamination by the Aspergillus flavus group, but the small proportion with toxigen potential.
Key words: micotoxin, contamination, toxigenic potential, health test.
INTRODUÇÃO
O amendoim (Arachis hypogaea L.) está sujeito à contaminação por fungos. A invasão por estes microrganismos pode ocorrer no solo, durante o processo de formação das sementes (ROSSETTO et al., 2003), na colheita (PITT et al., 1991), como também nas fases de secagem, beneficiamento e armazenamento (FERNANDEZ et al., 1997, ALMEIDA et al., 1998 e BRUNO et al., 2000). De acordo com MORAES & MARIOTTO (1985), os mais freqüentes são Aspergillus spp., Penicillium spp., Fusarium spp. e Rhizopus spp.
Em condições favoráveis, várias espécies fúngicas podem produzir micotoxinas, que são metabólitos secundários com potencial para causar toxicoses ao homem e aos animais, quando as sementes contaminadas são destinadas à alimentação. No grupo destas substâncias, as mais encontradas nos grãos de amendoim e em seus derivados, são as aflatoxinas B1, B2, G1 e G2 (HILL et al., 1983; KUMEDA & ASAO, 2001). Estas micotoxinas são produzidas, principalmente, por cepas toxígenas de Aspergillus flavus Link e por Aspergillus parasiticus Speare (ANGLE et al., 1982).
A identificação das espécies de fungos contaminantes é importante sinalizador da presença de micotoxinas nos substratos e pode ser utilizado como método preventivo (FARIAS et al., 2000). Entretanto, RANJAN & SINHA (1991) afirmam que o isolamento e a identificação desses fungos nem sempre estão ligados à detecção de micotoxinas no produto analisado, considerando que existem cepas dentro de uma mesma espécie que não possuem a capacidade de produção de metabólitos tóxicos. No armazenamento, o crescimento de Aspergillus flavus depende quase que exclusivamente do teor de água dos grãos em equilíbrio com a umidade relativa do ar, sendo que a temperatura determina a velocidade de crescimento. Assim, mantendo-se baixa a umidade relativa do ar, pode-se evitar a formação de aflatoxinas (DHINGRA & COELHO NETO, 1998). No entanto, conforme MIXON et al. (1984), a prevenção da contaminação por aflatoxina em grãos de amendoim pode ocorrer com a adoção de algumas práticas de produção, tais como rotação de culturas, irrigação, suplementação de minerais e adoção de procedimentos adequados de colheita e secagem.
Em condição de restrição hídrica, o amendoim pode não conter aflatoxinas se não for submetido à temperatura média de 25°C a 31°C durante a maturação, ou seja, nos últimos 40 a 75 dias antes da colheita (WILSON & STANSELL, 1983). Além disso, nesta condição, pode-se observar que a alta colonização por Aspergillus flavus pode estar relacionada à eliminação de A. niger, que compete com sucesso com A. flavus em condição de alta temperatura e umidade do solo (DHINGRA & COELHO NETTO, 1998). No entanto, de acordo com SANDERS et al. (1985), a colonização por Aspergillus flavus é inversamente proporcional à maturidade dos grãos, sendo maior em temperaturas elevadas, sob a condição de deficiência hídrica do solo. Os grãos imaturos de amendoim parecem possuir algum mecanismo de resistência, tal como maior conteúdo de água, que inibe o crescimento e a produção de aflatoxinas por A. flavus (COLE et al., 1985). DORNER et al. (1989) demonstraram que, quando o conteúdo de água dos grãos diminui durante o estresse hídrico, a capacidade destes de produzir fitoalexinas, que são antibióticos produzidos pela planta em resposta à invasão de certos patógenos (BASHRA et al., 1984), também diminui, resultando em atividade fúngica e contaminação por aflatoxinas.
Quanto à suplementação de minerais ao solo cultivado com amendoim, MIXON et al. (1984), REDING et al. (1993) e CLAVERO et al. (1994) constataram que a utilização de gesso foi particularmente efetiva na prevenção da incidência de Aspergillus spp. e de seus isolados aflatoxígenos. Da mesma forma, FERNANDEZ et al. (1997) observaram efeito favorável da aplicação de calcário. Estes resultados estão freqüentemente relacionados ao aumento de cálcio nos grãos, tornando o tegumento mais espesso (SMALL et al., 1989). Além disso, conforme PITT et al. (1991), o alto conteúdo de cálcio nos grãos pode diminuir o crescimento de Aspergillus flavus durante a secagem em campo.
O objetivo do trabalho foi avaliar a contaminação e o potencial para síntese de aflatoxinas pelos isolados do grupo Aspergillus flavus em grãos armazenados de amendoim (Arachis hypogaea L.), que foram produzidos com distintos procedimentos de calagem, de colheita e de secagem.
MATERIAL E MÉTODOS
Nos laboratórios de análise de sementes da UFRRJ e de pós-colheita da EMBRAPA/CTAA, em 2003, foram avaliadas doze amostras de grãos de amendoim (Arachis hypogaea L.), da cultivar Botutatu, que estavam armazenadas por 12 e 18 meses, em câmara seca (18oC e 45% de umidade relativa do ar). Estes grãos foram produzidos em Seropédica/RJ, no cultivo das águas (safra 2001/02), provenientes de plantas cultivadas em Planossolo, em áreas que receberam (CC) ou não (SC) a aplicação de calcário dolomítico (23,5% de CaO, 21,5 de MgO e 80% de poder relativo de neutralização total- PRNT), na dose de 1,8 t ha-1 e que apresentavam por ocasião da semeadura, de acordo com EMBRAPA (1997) respectivamente, 6,0 e 5,5 de pH (H20); 1,8 e 2,0 cmolc dm-3 de H++Al3+; 1,2 e 0,7 cmolc dm-3 de Ca2+; 0,5 e 0,2 cmolc dm-3 de Mg2+; 0,5 e 0,3 cmolc dm-3 de K+; 57 e 55% de saturação por bases. As plantas, conduzidas nestas áreas, foram colhidas aos 104 (1), 114 (2) e 124 (3) dias após a semeadura (DAS) e, secas em condições ambientais (A-26°C de temperatura e 68% de umidade relativa do ar) e em estufa (B - 30°C).
O delineamento experimental adotado foi o inteiramente casualizado em esquema fatorial (12 amostras x dois períodos de armazenamento), com quatro repetições. As amostras foram representadas pelas combinações dos tratamentos de campo: 1(E/1/CC), 2(E/1/SC), 3(E/2/CC), 4(E/2/SC), 5(E/3/CC), 6(E/3/SC), 7(A/1/CC), 8(A/1/SC), 9(A/2/CC), 10(A/2/SC), 11(A/3/CC) e 12 (A/3/SC) e, os períodos de armazenamento, por 12 e18 meses em câmara seca.
Foram selecionados 50 grãos aparentemente sadios e avaliados quanto ao teor de água (BRASIL, 1992), aos 12 e 18 meses. Estes grãos foram tratados com solução comercial de hipoclorito de sódio a 2% durante cinco minutos, lavados duas vezes em água esterilizada e transferidos assepticamente para placas de Petri esterelizadas contendo meio BDA (batata-dextrose-ágar) acrescido de NaCl (6%), conforme descrito por ITO et al. (1992). A incubação foi realizada a 20°C, por cinco dias. A avaliação dos grãos contaminados por Aspergillus spp., Penicillium spp., Fusarium spp., Cladosporium spp. e Rhizopus spp. foi realizada com auxílio de microscópios estereoscópico e óptico, de acordo com SILVEIRA (1981), SINGH et al. (1992) e PITT & HOCKING (1997).
Para caracterização dos isolados pertencentes a Aspergillus Secção Flavi (TAKAHASHI et al., 2002) e que corresponde ao grupo Aspergillus flavus (ABARCA, 2000), sem considerar a distinção de A. flavus e de A. parasiticus (KLICH & PITT, 1988), empregou-se o meio diferencial de Aspergillus (ADM), conforme BOTHAST & FENNELL (1974). Por tratamento, cinco isolados foram incubados por 72 horas a 25°C, na ausência de luz. A presença de pigmentação laranja-amarela no verso da colônia indicou reação positiva, isto é, que o isolado pertence ao grupo A. flavus.
Posteriormente, dois destes isolados, previamente identificados como do grupo Aspergillus flavus, foram submetidos à detecção de aflatoxinas na cultura, através da técnica de extração proposta por SINGH et al. (1992). Para isto, foram removidos discos de micélio do centro das culturas em meio YES, com sete dias de incubação. Posteriormente, através do método de cromatografia em camada delgada, estes discos de micélio, previamente macerados em cerca de 2ml de solução de clorofórmio e acetona (9:1), foram aplicados nas placas de sílica-gel, assim como, as alíquotas das soluções (5ml e 10ml) de trabalho do padrão de aflatoxina da marca Sigma (B1, B2, G1 e G2). Em seguida, estas placas foram colocadas em câmara de saturação com solução de clorofórmio e acetona, durante 15 minutos. A presença de toxinas foi identificada sob 366nm, por comparação com as soluções de trabalho. Posteriormente, foi obtida a porcentagem de isolados pertencentes ao grupo A. flavus, que apresentaram potencial para síntese de aflatoxinas (B1, B2, G1 e G2).
Os dados coletados foram submetidos à análise de variância. As variáveis em porcentagem foram transformadas previamente em arco seno da raiz quadrada de (x/100), sendo que nas tabelas encontram-se os dados originais. Para a comparação de médias, foi adotado o teste Tukey a 5% de probabilidade de erro.
RESULTADOS E DISCUSSÃO
As amostras de grãos de amendoim, denominadas 1, 2, 7 e 8, apresentaram as maiores porcentagens de Aspergillus spp., na avaliação realizada aos 12 meses de armazenamento. No entanto, as amostras 1, 2, 3, 4, 6, 7, 8, 9 e 10 apresentaram as maiores porcentagens de fungos deste gênero. Além disso, foi constatada maior incidência de Penicillium spp. nas amostras 1, 7 e 8 e, de Rhizopus spp., nas amostras 4, 6, 7, 8, e 10, aos 18 meses. Evidenciou que os grãos de amendoim das amostras 7 e 8 apresentaram maior contaminação fúngica, em relação aos das demais amostras. Avaliando o histórico de produção dos grãos de amendoim destas amostras, foi constatado que estes foram colhidos aos 104 DAS, precocemente em relação às demais colheitas, independente da planta-mãe ter desenvolvido ou não em área com calagem. No entanto, pelos resultados apresentados na literatura, pode-se constatar que REDING et al. (1993) e CLAVERO et al. (1994), realizando a suplementação do solo com gesso, assim como FERNANDEZ et al. (1997), utilizando calcário, verificaram efeitos favoráveis da aplicação de cálcio fornecido por estes produtos, na inibição do crescimento, principalmente, de Aspergillus spp. nos grãos de amendoim, devido ao fato do tegumento tornar-se mais espesso e, conseqüentemente, oferecer maior resistência à colonização fúngica, como também constatado por SMALL et al. (1989). Porém, ROSSETTO et al. (2003), por ocasião da avaliação realizada imediatamente após a colheita, constataram que a calagem não interferiu na prevenção da contaminação por Aspergillus spp. nos grãos de amendoim. Além disso, avaliando as condições climáticas no período de colheita dos grãos das amostras 7 e 8, foi constatado que dos 104 aos 124 DAS, a temperatura média foi de 27,7°C e não ocorreu precipitação pluvial (dados não apresentados). Assim, estas condições podem ter favorecido a contaminação fúngica dos grãos destas amostras. No entanto, para COLE et al. (1985), os grãos imaturos, por apresentarem maior conteúdo de água, parecem possuir algum mecanismo de resistência, que inibe o desenvolvimento de fungos.
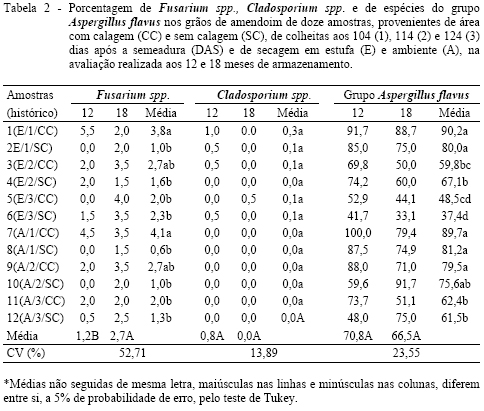
Foi verificado aos 18 meses, menor porcentagem de Aspergillus spp. nas amostras 1 e 2, do que na avaliação realizada aos 12 meses (Tabela 1). Em relação ao grupo Aspergillus flavus, a maior incidência destes fungos foi constatada nos grãos das amostras 1, 2, 7, 8, 9 e 10, independente do período de armazenamento (Tabela 2). Pelo histórico de produção dos grãos de amendoim destas amostras, pode-se verificar que estes, independentemente dos procedimentos de calagem e de secagem, foram colhidos aos 104 e 114 DAS, em período que não ocorreu precipitação pluvial. Também, SANDERS et al. (1985), em condição de deficiência hídrica do solo, observaram favorecimento da contaminação dos grãos pelo grupo A. flavus. De acordo com DHINGRA & COELHO NETTO (1998), nesta condição, a alta colonização por A. flavus pode estar relacionada à eliminação de competidores como A. niger, que compete com A. flavus, em associação a alta temperatura e umidade do ar.
Foi constatado que, independente da amostra, não houve diferença de porcentagem de espécies do grupo Aspergillus flavus, nas avaliações realizadas aos 12 e 18 meses de armazenamento. Já, em relação à incidência de Fusarium spp., foi verificado maior incidência de destes fungos na avaliação realizada aos 18 meses do que aos 12 meses (Tabela 2). De acordo com DHINGRA & COELHO NETTO (1998), a prevenção da contaminação por fungos durante o armazenamento ocorre quando a umidade relativa do ar é baixa e, conseqüentemente, o teor de água dos grãos é menor. Assim, neste trabalho, as variações na incidência fúngica podem ter sido devido à competição intraespecífica dos fungos por substrato, como também constatado por GURJÃO (1995), uma vez que durante o armazenamento destas doze amostras de grãos de amendoim, não houve oscilação na temperatura e umidade relativa do ar e, conseqüentemente, no conteúdo de água dos grãos, que permaneceu neste período em torno de 6,0% (dados não apresentados).
Foi constatada maior porcentagem de isolados do grupo A. flavus, com potencial para síntese de aflatoxina B1, nas amostras de grãos de amendoim, denominadas 5 e 11, na avaliação realizada aos 12 meses de armazenamento e, nas amostras 5, 6, 7 e 12, aos 18 meses (Tabela 3). Além disso, foi verificado maior porcentagem de isolados do grupo A. flavus com potencial para produção de B2, nas amostras 2, 3, 4, 5, 6, 7, 8, 10, 11 e 12, aos 18 meses. Assim, evidenciando o potencial toxígeno dos isolados da amostra 5, em relação aos das demais amostras. Pela avaliação da contaminação fúngica, os grãos desta amostra, assim como o da amostra 6, apresentaram as menores porcentagens de espécies do grupo A. flavus (Tabela 2). Assim, a maior incidência de espécies do grupo A. flavus (Tabela 2) não foi pré-requisito para a produção de aflatoxina (Tabela 3), pois nem todos os isolados pertencentes a este grupo apresentaram potencial toxígeno.
Comparando os períodos de armazenamento, foi constatado maior porcentagem de isolados do grupo Aspergillus flavus com potencial para produção de aflatoxina B2 nos grãos das amostras 7 e 8, assim como com potencial para aflatoxina B1 nos grãos da amostra 11, na avaliação realizada aos 18 meses do que aos 12 meses de armazenamento (Tabela 3). Pelo histórico de produção, estes grãos foram colhidos aos 124 DAS, mais tardiamente em relação às demais colheitas. Também, ROSSETTO et al. (2003) constataram que os grãos de amendoim colhidos aos 124 DAS, apresentam menor contaminação pelo grupo Aspergillus flavus, assim como tendência de aumento dos isolados com potencial aflatoxígeno, por ocasião da avaliação realizada imediatamente após a colheita. De acordo com SANDERS et al. (1985) e COLE et al. (1985), a colonização por Aspergillus flavus é inversamente proporcional à maturidade dos grãos, que apresentam maior conteúdo de água, sendo intensa em condição de deficiência hídrica do solo. A diminuição do conteúdo de água dos grãos, sob estresse hídrico, reduz a capacidade destes de produzir antibióticos, resultando em atividade fúngica e contaminação por aflatoxina (DORNER et al., 1989). No entanto, WILSON & STANSELL (1983) constataram que o amendoim sujeito à deficiência hídrica do solo, pode não conter aflatoxina se não for submetido à temperatura média de 25 a 31°C, na fase de maturação, ou seja, nos últimos 40 a 77 dias antes da colheita.
CONCLUSÃO
Os grãos de amendoim, provenientes da colheita antecipada, apresentaram maior contaminação pelo grupo Aspergillus flavus, sendo menor a proporção destes com potencial toxígeno.
Recebido para publicação 18.05.04
Aprovado em 03.11.04
- ABARCA, M.L. Taxonomia e identificación de espécies implicadas en la aspergilosis nosocomial. Revista Iberoamericana de Micologia, Bilbao, v.17, n.1, p.S79-S84, 2000.
- ALMEIDA, F.A.C. et al. Influência do beneficiamento, da embalagem e do ambiente de armazenamento na qualidade sanitária de sementes de amendoim. Revista Oleaginosa e Fibrosa, Campina Grande, v.2., n.2, p. 97-102, 1998.
- ANGLE, J.S. et al. Effect of cultural practices on the soil populations of Aspergillus flavus and Aspergillus parasiticus Soil Science Society of America Journal, Madison, v.46, n.2, p.301-303, 1982.
- BASHRA, S.M. et al. A phytoalexin and aflatoxin producing peanut seed culture system. Peanut Science, Raleigh, v.21, p.130-134, 1984.
- BOTHAST, R.J.; FERNELL, D.I. A medium for rapid identification and enumeration of Aspergillus flavus and related organisms. Mycologia, Lawrence, v.66, n.3, p.365-369, 1974.
- BRASIL. Ministério da Agricultura e da Reforma Agrária. Regras para Análise de Sementes Brasília : SNAD/DNPV/CLAV, 1992. 365p.
- BRUNO, R.L.A. et al. Qualidade fisiológica e microflora de sementes de amendoim cv. Br-1 durante o armazenamento. Revista de Oleaginosa e Fibrosa, Campina Grande, v.4, n.3, p.141-152, 2000.
- CLAVERO, M.R. et al. Aspergillus parasiticus NRRL 2667 growth and aflatoxin synthesis as affected by calcium content and initial spore load in single peanuts. Journal of food protection, Ames, v.57, n.5, p.415-418, 1994.
- COLE, R.J. et al. Mean geocarposphere temperature that induce pre-harvest aflatoxin contamination of peanuts under drought-stressed. Mycopathologia, Dordrecht, v.91, n.3, p.41-46, 1985.
- DHINGRA, O.D.; COELHO NETO, R.A. Micotoxinas em grãos. Revisão Anual de Patologia de Plantas, Passo Fundo, v.6, n.1, p.49-101, 1998.
- DORNER, J.W. et al. Interrelatioship of kernel water activity, soil temperature, maturity, and phytoalexin production in preharvest aflatoxin contamination of drought stressed peanuts. Mycopathologia, Dordrecht, v.105, p.117-128, 1989.
- EMBRAPA. Centro Nacional de Pesquisa de Solos. Manual de Métodos de Análise de Solos 2.ed. Rio de Janeiro: Centro Nacional de Pesquisa de Solos, 1997. 212p.
- FARIAS, A.X. et al. Contaminação endógena por Aspergillus spp em milho pós-colheita no Estado do Paraná. Pesquisa Agropecuária Brasileira, Brasília, v.35, n.3, p.617-621, 2000.
- FERNANDEZ, E. et al. Fungus incidence on peanut grains as affected by drying method and Ca nutrition. Field Crops Research, Amesterdan, v.52, n.1, p.9-15, 1997.
- GURJÃO, A.C. de O. Qualidade fisiológica, nutricional e sanitária de sementes de amendoim (Arachis hypogaea L.) produzidas no semi-árido nordestino 1995. 88f. Dissertação (Mestrado em Produção Vegetal) - UFPB.
- HILL, R.A et al. Effect of soil moisture and temperature on preharvest invasion of peanuts by the Aspergillus flavus group and subsequent aflatoxin development. Applied and Environmental Microbiology, Washington, v.45, n.2, p.628-633, 1983.
- ITO, M.F. et al. Comparação de métodos para detecção de Aspergillus spp e Penicillium spp em sementes de amendoim (Arachis hypogaea). Summa Phytopathologica, Jaguariuna, v.18, n.3, p.262-268, 1992.
- KLICH, M.A.; PITT, J.I. Differentiation of Aspergillus flavus from A. parasiticus and other closely related species. Transaction of the British Mycological Society Cambridge, London, v.91, p.99-108, 1988.
- KUMEDA, Y.; ASSAO, T. Heteroduplex panel analysis, a novel method for genetic identification of Aspergillus Section Flavi strains Applied and Environmental Microbiology, Washington, v. 67, n.9, p.4084-4090, 2001.
- MORAES, S.A.; MARIOTTO, P.R. Diagnóstico da patologia de sementes de amendoim no Brasil. Revista Brasileira de Sementes, Brasília, v.7, n.1, p.41-43, 1985.
- MIXON, A.C. et al. Effect of chemical and biological agents on the incidence of Aspergillus flavus and aflatoxin contmination of peanut seed. Phytopathology, v.74, n.2, p.1440-1444, 1984.
- PITT, J.I. et al. Systemic invasion of developing peanut plants by Aspergillus flavus Letters in Applied Microbiology, Oxford, v.13, n.1, p.16-20, 1991.
- PITT, J.L.; HOCKING, A.D. Fungi and food spoilage London : Blackie Academic & Professional, 1997. 175p.
- RANJAN, K.S; SINHA, A.K. Occurrence of mycotoxigenic fungi and mycotoxins in animal feed from Bihar, India. Journal of the science of food and agriculture, Essex, v.56, n.1, p.39-47, 1991.
- REDING, C.L. et al. Aspergillus parasiticus growth and aflatoxin synthesis on florunner peanuts grown in gypsum-supplemented soil. Journal of food protection, Ames, v.56, n.7, p.593-594. 1993.
- ROSSETTO, C.A.V. et al. Contaminação fúngica do amendoim em função das doses de calcário e das épocas de amostragem. Bragantia, Campinas, v.62, n.3, p.437-445, 2003.
- SANDERS, T.H. et al. Relation of environmental stress duration to Aspergillus flavus invasion and aflatoxin production in preharvest peanuts. Peanut Science, Releigh, v.12, n.8, p.90-93, 1985.
- SILVEIRA, V.D. Micologia 5.ed. Rio de Janeiro : Âmbito Cultural, 1981. 332p.
- SINGH, K et al. An illustrated manual on identification of some seed-borne Aspergilli, Fusaria, Penicillia and their mycotoxins Copenhagen : Danish Government Institute of Seed Pathology for Developing Countries Ryvanges, 1992. 133p.
- SMALL, H. et al. Solution Ca concentration and application date effect on pod calcium uptake and distribution in Florunner and Tifton-8 peanut. Journal of Plant Nutrition, New York, v.12, n.1, p.37-52, 1989.
- TAKAHASHI, T. et al. Nonfunctionality of Aspergillus sojae aflR in a strain of Aspergillus parasiticus with a Disrupted aflR gene. Applied an Environmental Microbiology, Washington, v.68, n.8, p.3737-3743, 2002.
- WILSON, D.M.; STANSELL, J.R. Effect of irrigation regimes on aflatoxin contamination of peanut pods. Peanut Science, Raleigh, v.10, n.1, p.54-56, 1983.
Datas de Publicação
-
Publicação nesta coleção
04 Mar 2005 -
Data do Fascículo
Abr 2005
Histórico
-
Recebido
18 Maio 2004 -
Aceito
03 Nov 2004