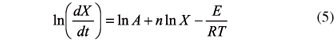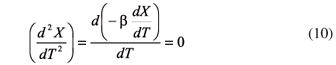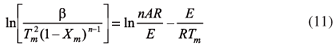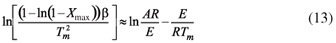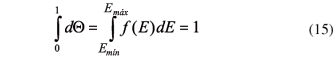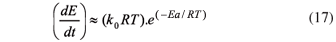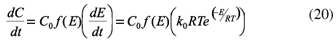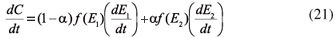Resumen
The study of pyrolysis is gaining increasing importance, since it is the first step in the gasification or combustion process. In this study, pyrolysis experiments of cypress pine were carried out in a thermogravimetric analyzer at six different heating rates between 5 and 40 ºC / min. Kinetics parameters of pine were determined from TGA by using the differential and the maximum speed methods. Additionally, the distribution of activation energies was also carried out finding the values of 113.57 and 157.32 kJ/mol, which are in the range of activation energies reported for hemicellulose and cellulose, respectively, main components of wood.
pyrolysis; TGA; kinetics
pyrolysis; TGA; kinetics
ARTIGO
Determinación de los parámetros cinéticos en la pirólisis del pino ciprés
Determination of kinetics parameters in the pyrolysis of cypres pine
Nancy Acelas Soto; Wilson Ruíz Machado; Diana López López* * e-mail: dplope@gmail.com
Instituto de Química, Facultad de Ciencias Exactas y Naturales, Universidad de Antioquia, Sede de Investigación Universitaria, Medellín, Colombia
ABSTRACT
The study of pyrolysis is gaining increasing importance, since it is the first step in the gasification or combustion process. In this study, pyrolysis experiments of cypress pine were carried out in a thermogravimetric analyzer at six different heating rates between 5 and 40 ºC / min. Kinetics parameters of pine were determined from TGA by using the differential and the maximum speed methods. Additionally, the distribution of activation energies was also carried out finding the values of 113.57 and 157.32 kJ/mol, which are in the range of activation energies reported for hemicellulose and cellulose, respectively, main components of wood.
Keywords: pyrolysis; TGA; kinetics.
INTRODUCCIÓN
Dentro de las nuevas alternativas que se han implementado para tratar de disminuir la cantidad de emisiones de CO2, SOx, NOx y material particulado producidas durante procesos de producción de energía, la biomasa surge como una fuente renovable que no solo permite reemplazar parcialmente los combustibles fósiles, sino también reducir las concentraciones de éstos gases contaminantes emitidas a la atmósfera.1 La transformación termoquímica de la biomasa puede generar combustibles sólidos, líquidos y gaseosos, los cuales pueden reemplazar parcialmente los combustibles fósiles para producir calor, electricidad o productos químicos. Dentro de los procesos de transformación termoquímica la pirólisis y la gasificación son los más usados comercialmente.2
La madera es un representante de la biomasa que contiene principalmente celulosa, hemicelulosa y lignina. Su descomposición térmica revela dos regiones principales atribuidas a la descomposición de la celulosa y la hemicelulosa. La primera descomposición con pérdidas de masa que se presenta a bajas temperaturas puede asociarse al proceso de pirólisis de la hemicelulosa y a temperaturas más elevadas la pérdida en masa se asocia con descomposición de celulosa. Por otro lado, pérdidas en masa para la descomposición de lignina no se observan en este rango de temperaturas. El conocimiento de la devolatilización de la madera es importante, porque la pirólisis es el primer paso en un proceso de gasificación o combustión.3
La variable composición de la biomasa, combinado con el diferente comportamiento de descomposición de cada componente, es el resultado de la diversidad del comportamiento de pirólisis para cada tipo de biomasa.4
En éste trabajo, los parámetros cinéticos tales como, energía de activación y factor pre-exponencial, fueron determinados para el pino ciprés usando el método termogravimétrico no-isotérmico y tratando los datos obtenidos bajo los modelos matemáticos del método diferencial y del método de la velocidad máxima, y adicionalmente realizando la distribución de energías de activación.
PARTE EXPERIMENTAL
Muestra
Se utilizó pino ciprés con un tamaño de partícula aproximado de 40 µm; la humedad fue eliminada inicialmente a temperatura ambiente y luego en la estufa a 110 ºC, para los dos casos anteriores se monitoreó hasta la obtención de un peso constante.
Caracterización del material
Los análisis próximo y elemental para la muestra se indican en la Tabla 1. Estos se realizaron usando un analizador termogravimétrico (TGA 2950) y un CHN (Perkin Elmer 2400), respectivamente. Los resultados de la composición del pino se encuentran en la Tabla 2, el análisis de lignina se realizó de acuerdo a la norma ASTM 1105 y la holocelulosa (celulosa y hemicelulosa) contenida en la madera, libre de extractos se encuentra como el residuo que queda después de analizar la lignina.
Método
Los análisis termogravimétrico (TGA) y termogravimétrico derivativo (DTG) fueron usados para éste estudio. El modelo no-isotérmico fue llevado a cabo en el TGA 2950 con una velocidad de calentamiento (β) hasta 120 ºC, se deja en isoterma por 12 min y luego se lleva el sistema a una temperatura de 700 ºC a la misma velocidad de calentamiento para continuar con una isoterma durante 30 min. Se analizaron muestras entre 15-20 mg, con el fin de reducir los efectos de transferencia de masa y de transferencia de calor, ya que la presencia de gradientes de temperatura en el lecho del material y de las partículas ocasionan que la biomasa no reaccione de manera homogénea y se presenten diferencias en la secuencia de las reacciones, debidas a las condiciones de transporte de los productos primarios de las reacciones hacia el exterior de las partículas y a través del lecho del material. Estos procesos de transporte son responsables en gran parte de las reacciones secundarias, que se generan a partir de los productos primarios de la pirólisis de biomasa.5 Estos estudios de pirólisis se llevaron a cabo usando nitrógeno como gas de reacción y antes de iniciar cada experimento se realizó una purga en nitrógeno (N2) durante 20 min a todas las muestras con un flujo de 100 mL/min.
La pirólisis de biomasa es un proceso complejo debido principalmente a la diversidad de comportamiento ante la degradación térmica de sus tres principales componentes: celulosa, hemicelulosa y lignina, por lo que es muy difícil con un solo mecanismo explicar el comportamiento de todos los tipos de biomasa, sin embargo, a nivel cualitativo se ha logrado predecir que la hemicelulosa es el componente más inestable térmicamente, por lo que reaccionará en primer lugar seguido por la celulosa y por último la lignina que es más resistente a altas temperaturas.5
MODELOS CINÉTICOS
Método diferencial
Los resultados experimentales termogravimétricos son expresados como función de la conversión, X, la cual se define como
donde W0 es la masa inicial de la muestra; W es la masa de la muestra a un tiempo (t) y Wα es la masa final del residuo.6
La velocidad de conversión dX/dt, en la descomposición térmica es expresada como,
La constante de la velocidad de reacción k, es expresada por la Ecuación de Arrhenius
La función de la conversión independiente de la temperatura f(X), se expresa como,
sustituyendo la Ecuación 3 y la Ecuación 4 en la Ecuación 2 y tomando logaritmo natural a ambos lados de la ecuación se tiene,
Para diferentes velocidades de calentamiento, la temperatura requerida para alcanzar la misma conversión X y la velocidad instantánea de reacción (dX/dt) difiere para la misma muestra.
La energía de activación y el factor pre-exponencial pueden ser determinados de la relación entre ln(dX/dt) y 1/T para cada conversión.
Método de la velocidad máxima
Para una temperatura a la cual ocurre la máxima reacción de pirólisis, Tmax, se tiene de acuerdo a Redhead que:7
De acuerdo a la ecuación teórica, la ecuación cinética para la descomposición de un sólido es usualmente escrita como:
donde t es el tiempo de reacción, n es el orden de reacción y k es la constante de velocidad de la reacción. En la ecuación anterior de acuerdo con la ecuación de Arrhenius, la expresión de la constante de velocidad de la reacción k, es la siguiente:
donde A es el factor pre-exponencial, E es la energía de activación aparente y R es la constante de los gases (R = 8.314 J/mol).
La Ecuación 8 se puede reemplazar en la Ecuación 7 para obtener la Ecuación 9, la cual puede expresarse en función de la velocidad de calentamiento.
Tomando a la Ecuación 6 como:
Sustituyendo la Ecuación 9 en la Ecuación 10 se obtiene:
donde Tmes la temperatura a la velocidad máxima de reacción y Xm es la conversión a la velocidad de máxima reacción. Si n = 1 la Ecuación 11 se puede simplificar como:
Para la misma muestra, la temperatura máxima (Tm) puede ser calculada de la curva de la pérdida de peso, con diferentes velocidades de calentamiento. Al graficar ln(β/Tm2)Vs 1/Tm, la energía de activación aparente (Eα) y el factor pre-exponencial (A), pueden ser calculados de la pendiente y el intercepto, respectivamente.8
Ahora, para cada velocidad de calentamiento se pueden obtener los valores de máxima conversión (1 - Xmax) a una Tm, los cuales se pueden relacionar aproximando la Ecuación 11 como:
donde del intercepto y la pendiente también se pueden calcular los parámetros cinéticos (Eα) y (A) de Arrhenius.
Función de distribución de energías de activación
Para los procesos de descomposición de biomasa generalmente se obtienen los parámetros cinéticos para un orden de reacción uno, en el cual para una masa inicial del material C* tiene una dependencia en la energía de activación y por lo tanto la fracción de volátiles (dC*) que evolucionan del material se puede asumir que satisface la siguiente distribución de energías,
Luego podría plantearse la siguiente equivalencia entre la fracción de volátiles durante la descomposición del material y la probabilidad de distribución de energía del material pirolizado, la cual es lineal para la función f(E) y no presenta una forma conocida o determinada, pero que puede satisfacer las condiciones generales de una función de densidad de probabilidad; esto es, que no sea negativa y que esta pueda ser normalizada a la unidad:
Teniendo presente que la fracción de volátiles con respecto a la masa total es dΘ= C/C0, esta se reemplaza en (15) y luego tomando la derivada con respecto al tiempo se obtiene la expresión:9-12
La Ecuación 16 puede emplearse para obtener a partir de los perfiles de descomposición la distribución de energías de activación. El término (dE/dt) puede calcularse mediante la aproximación propuesta por Du y otros:13
donde podemos emplear la siguiente aproximación para determinar la energía de activación:
definiendo  ; haciendo u = 1n(z) y v=ln(u); con
; haciendo u = 1n(z) y v=ln(u); con 
La Ecuación 18 es aplicable cuando se tiene una temperatura máxima de descomposición, Tmax, la cual esta está a su vez relacionada con el centro de la distribución de energías de activación (E*) y el factor pre-exponencial A.
Luego la función de distribución de energías puede calcularse como:
Por último si existen dos o más procesos de descomposición, se pueden emplear varias funciones f(E) de distribución:
donde α es la fracción total de volátiles que desorben del material con diferentes energías de activación.
RESULTADOS Y DISCUSIÓN
Características de la degradación térmica
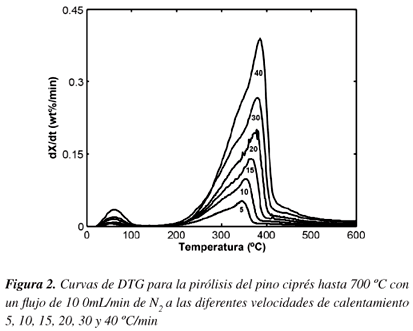
Las curvas del TGA y DTG de la muestra bajo atmósfera de nitrógeno (atmósfera inerte) son dadas en las Figuras 1-2 y son usadas para determinar las características térmicas de la muestra de biomasa.
El grado de conversión Vs la temperatura a las diferentes velocidades de calentamiento (β), entre 5 y 40 ºC/min para el pino ciprés son mostrados en la Figura 1. A temperaturas menores que 200 ºC hay un pequeño cambio en la conversión de la muestra y normalmente es atribuido la eliminación de la humedad que está ligada sobre la superficie de la muestra. El pino ciprés empieza su descomposición alrededor de 250 ºC como se muestra en las Figuras 1 y 2. Además se observa el desplazamiento de las curvas hacia la derecha a medida que aumenta la velocidad de calentamiento. Las curvas del TGA muestran que la mayor descomposición ocurre entre 220 y 414 ºC. Teniendo en cuenta que la biomasa contiene principalmente celulosa, hemicelulosa y lignina se ha encontrado que la celulosa se descompone entre 277 y 427 ºC, la hemicelulosa alrededor de 197 y 327 ºC y la lignina entre 277 y 527 ºC,13 se observó que la descomposición del pino después de 400 ºC avanza más lentamente debido a las características de la lignina.4
La velocidad diferencial de conversión, dX/dt, fue obtenida de los análisis del DTG a diferentes velocidades de calentamiento, se observa un pico de máxima descomposición en el intervalo de temperatura entre 220 y 414 ºC, el cuál es atribuido a la descomposición de la celulosa y la hemicelulosa. Con el aumento de la velocidad de calentamiento se observa un desplazamiento hacia la derecha de los picos de máxima descomposición (Figura 2); éste desplazamiento se ve favorecido debido a que hay mayores tiempos de reacción a temperaturas mayores, además la máxima velocidad de descomposición tiende a incrementar a mayores velocidades de calentamiento porque se provee una mayor energía térmica que facilita la transferencia de calor alrededor y dentro de las muestras.5
Parámetros cinéticos del pino ciprés determinados por el método diferencial y el método de la velocidad máxima
Los análisis de los gráficos del TGA fueron usados para determinar los parámetros cinéticos del pino ciprés, tales como energía de activación (Eα) y factor de frecuencia de Arrhenius (A).
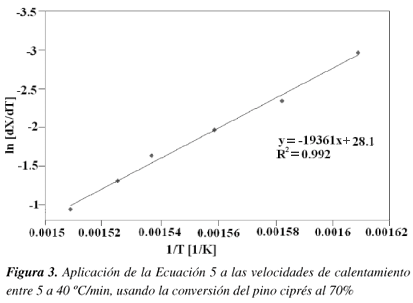
Basados en la Ecuación 5 la energía de activación (Eα) se determina por la relación entre ln(dX/dt) y 1/T. La Figura 3 muestra la relación entre ln(dX/dt) y 1/T, a la conversión del 70%, resultando una línea recta con la pendiente -E/R ,del intercepto se determina el factor de frecuencia para una conversión dada cuando el orden de reacción (n) se asume que es 0, 1 o 2.
Usando la Ecuación 5 se calculó la energía de activación a varias conversiones. La energía de activación para el pino ciprés va desde 73.86 hasta 289.15 kJ/mol dependiendo de la conversión (Tabla 3).
Puede observarse que aunque no hay una tendencia bien definida, los valores mayores de energía de activación se encuentran para las conversiones de 60-85%, esto puede ser atribuido a otras reacciones de devolatilización después de la reacción principal.
Font y otros,14 determinaron energías de activación para los tres componentes principales de la biomasa (celulosa, hemicelulosa y lignina) encontrando que, la hemicelulosa presenta una energía de activación entre 130 y 140 kJ/mol, la celulosa entre 200 y 240 kJ/mol y la lignina entre 190 y 200 kJ/mol. De acuerdo con éste reporte de la literatura, en nuestro caso la celulosa y la hemicelulosa iniciaron su descomposición desde la conversión del 10% aproximadamente, con un promedio de energía de activación de 174.62 kJ/mol. La Tabla 3 muestra los factores pre-exponenciales calculados con la Ecuación 5 para una conversión dada y asumiendo un orden de reacción de cero, uno y dos. Cuando la conversión llega al 85% hay un mayor incremento en el factor pre-exponencial, atribuido probablemente a las devolatilizaciones del carbonizado residual.
Usando los datos de (dX/dT) y Tmáx(Figura 2), se pudo determinar la temperatura máxima (Tm) de pirólisis a las diferentes velocidades de calentamiento (β). Como ejemplo se presenta la Figura 4, en la cual se muestra que para cada velocidad de calentamiento existe una temperatura máxima de descomposición relacionada con una conversión máxima. Estos datos a su vez son los que se utilizan para la determinación de la energía de activación y el factor pre-exponencial en los modelos matemáticos antes mencionados. Igualmente para obtener las curvas de distribución de energía de activación, la Tmax se emplea para determinar el centro de la distribución de energía (E*).
Empleando los datos obtenidos para cada velocidad de calentamiento, se usó la Ecuación 12, en la cual mediante la relación (β/T2m) Vs 1/Tm, la energía de activación (Eα) y el factor pre-exponencial (A) pueden ser determinados por la pendiente y el intercepto, respectivamente, de igual manera usando la Ecuación 13 con la relación  estos parámetros pueden ser determinados. Los resultados se pueden ver en la Tabla 4 y en la Figura 5.
estos parámetros pueden ser determinados. Los resultados se pueden ver en la Tabla 4 y en la Figura 5.
En la Figura 5, puede observarse que las dos gráficas son casi paralelas entre si, por lo que los valores de la pendiente e intercepto son parecidos y por tanto, la energía de activación (Ea) y el factor pre-exponencial (A) para ambos modelos son similares (Tabla 4), lo que comprueba que éstos parámetros cinéticos son independientes de conversión.
Las energías de activación encontradas por el método de la velocidad máxima (Ecuaciones 12 y 13) son similares al valor dado por el método diferencial cuando se tiene una conversión del 10%. Durante el proceso de calentamiento, en primer lugar se darán las reacciones menos energéticas y luego con el aumento de la temperatura procederán las reacciones más energéticas, lo cual da como resultado una mayor energía de activación aparente.
Función de distribución de energías de activación
En éste modelo se asume que el material bajo descomposición está compuesto por diferentes fracciones cada una de ellas caracterizada por ser una reacción de descomposición de primer orden para los cuales la energía de activación es una función de distribución continua. Este método es conocido porque determina la energía de activación y su distribución, cuyos resultados concuerdan perfectamente los valores de Ea para varias velocidades de calentamiento con su Tmax, a partir de los datos experimentales obtenidos en un TGA.15
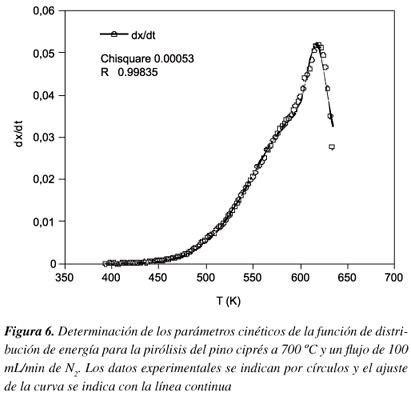
Los parámetros cinéticos de la función de distribución de energía para la pirólisis del pino ciprés se determinaron empleando un método estocástico, en el cual se programan las Ecuaciones 18 a 21 y se utilizan funciones de distribución Gaussiana. El algoritmo utilizado es el de Levenberg-Marquardt,16 también llamado minimización Chi-square, el cual realiza el ajuste de los datos experimentales, (dX/dt) Vs. T, hasta encontrar los mejores parámetros de la función que minimizan la desviación con respecto a la curva teórica. En el presente caso se obtienen ocho parámetros que dan cuenta de dos funciones de distribución como son el factor pre-exponencial (A), la energía de activación (Ea), la varianza de la distribución (σ) y el factor de peso ( α) que esta relacionado con la fracción de volátiles. De la Figura 6 también se puede observar el valor del cuadrado de las desviaciones, Chi-square, (Chisq=0.0005) y el coeficiente de correlación (R=0.9985) que dan cuenta de la buena aproximación que existe entre la curva teórica calculada con respecto a los datos experimentales.
En la Tabla 5 se listan los parámetros calculados mediante este algoritmo, donde la primera energía de activación y el primer factor pre-exponencial corresponderán probablemente a la descomposición de la hemicelulosa (Tmáx 315ºC) y los segundos parámetros a la descomposición de la celulosa (Tº 347ºC). Para la lignina no es posible diferenciar o calcular su energía de activación debido a que en el rango de temperaturas trabajadas ésta entra a formar parte del coque en el proceso de pirólisis por presentar estructuras muy estables.
CONCLUSIONES
Los análisis termogravimétricos para la pirólisis del pino ciprés fueron utilizados para determinar los parámetros cinéticos, tales como, energía de activación y factor pre-exponencial. La energía de activación determinada por el método diferencial estuvo en el rango de 97.12-196.47 kJ/mol, las cuales dependen del grado de conversión. Los valores de los factores pre-exponenciales encontrados asumiendo un orden de reacción de cero, uno y dos para cada conversión, se encuentran en el rango de 6.17x105 s-1 - 1.25x1021 s-1.
Pudo comprobarse que los parámetros cinéticos tales como el factor pre-exponencial y la energía de activación de la pirólisis del pino ciprés son independientes de la conversión.
El pino ciprés se descompuso en el rango de temperaturas entre 220 y 414 ºC, lo cual sugiere que éste tipo de biomasa contiene mayor cantidad de hemicelulosa y celulosa.
Con la función de distribución de energías de activación pudo identificarse principalmente dos energías de activación, 113.77 y 157.32 kJ/mol, las cuales están en el rango de energías de activación reportadas para la hemicelulosa y la celulosa, respectivamente. Estos resultados están de acuerdo con la energía de activación obtenida de 156 kJ/mol por el método de velocidad máxima. Estos valores de energías de activación y factores pre-exponenciales estarían asociados a la cinética de descomposición de la hemicelulosa y la celulosa del pino ciprés respectivamente.
AGRADECIMIENTOS
Al programa Sostenibilidad 2009-2010 de la Universidad de Antioquia. N. Acelas agradece al programa jóvenes investigadores de la Universidad de Antioquia por la ayuda económica suministrada.
Recebido em 9/10/09; aceito em 24/3/10; publicado na web em 13/8/10
- 1. Tanga, L.; Huanga, H.; Fuel 2005, 85, 2055.
- 2. Wanignon, F. F.; Laurent, V.; Siaka, T.; Ghislaine, V.; Philippe, G.; Fuel Process. Technol 2009, 90, 17.
- 3. Muller, M.; Bockhorn, H.; Krebs, L.; Muller, U.; J. Anal. Appl. Pyrolysis 2003, 68, 231.
- 4. Xiaodong, Z.; Min, X.; Rongfeng, S.; Sun, l.; J. Eng. Gas Turbines 2006, 128, 493.
- 5. Alexander, G.; Wolfgang, K.; Sonia, R.; Tesis de Doctorado, Universidad Nacional de Colombia, Colombia y Universidad de Kassel, Alemania, 2008.
- 6. Young, H.; Young, P.; Jinsoo, K.; Seung, S.; Seung, K.; Bioresour. Technol 2009, 100, 400.
- 7. Masel, R.: Principles of adsorption and reaction on solid surfaces, University of Illinois at Urbana Champaign: Illinois, 1951.
- 8. Shuyuan, L.; Changtao, Y.; Fuel Process. Technol 2003, 85, 51.
- 9. Suuberg, E.; Combust. Flame 1983, 50, 243.
- 10. Du, Z. Y.; Sarofim, A. F.; Longwell, J. P.; Energy Fuels 1990, 4, 296.
- 11. Miura, K.; Maki, T.; Energy Fuels 1998, 12, 864.
- 12. Teng, H.; Hsieh, C. T.; Ind. Eng. Chem. Res 1999, 38, 292.
- 13. Du, Z. Y.; Sarofim, A. F.; Longwell, J. P.; Energy Fuels 1990, 4, 296.
- 14. Font, R.; Conesa, J. A.; Molto, J.; Muñoz, M.; J. Anal. Appl. Pyrolysi 2008, 85, 276.
- 15. Casajusa, C.; Abrego, J.; Marias, F.; Vaxelaire, J.; Sánchez, J.; Gonzalo, A.; Chem. Eng. J 2009, 145, 412.
- 16. William, H.; Saul, A.; William, T.; Brian, P.; Numerical Recipes in C: The art of scientific computing, Cambridge University: Cambridge, 1992.
Fechas de Publicación
-
Publicación en esta colección
27 Set 2010 -
Fecha del número
2010
Histórico
-
Acepto
24 Mar 2010 -
Recibido
09 Oct 2009