Resumo
It is argued that the invariants associated to the First Law of Thermodynamics and to the concept of identical processes lead to a clear definition of heat and work. The conditions for heat and work to be invariant under a system-surroundings interchange are also investigated. Finally, examples are presented to illustrate the above conditions.
heat; work; invariance
heat; work; invariance
EDUCAÇÃO
Calor e trabalho: são estes conceitos invariantes sob a permuta sistema-vizinhança?
Heat and work concepts: are they invariant under a system-surroundings interchange?
Joaquim Anacleto1,* * e-mail: anacleto@utad.pt ; José M. FerreiraII
IDepartamento de Fisica, Universidade de Trás-os-Montes e Alto Douro, Apartado 1013, P-5001-801 Vila Real, Portugal / IFIMUP and IN - Institute of Nanoscience and Nanotechnology, Departamento de Fisica da Faculdade de Ciências da Universidade do Porto, Rua do Campo Alegre, 687, P-4169-007 Porto, Portugal
IIDepartamento de Fisica, Universidade de Trás-os-Montes e Alto Douro, Apartado 1013, P-5001-801 Vila Real, Portugal
ABSTRACT
It is argued that the invariants associated to the First Law of Thermodynamics and to the concept of identical processes lead to a clear definition of heat and work. The conditions for heat and work to be invariant under a system-surroundings interchange are also investigated. Finally, examples are presented to illustrate the above conditions.
Keywords: heat; work; invariance.
INTRODUÇÃO
Embora os conceitos de calor, Q, e de trabalho, W, sejam essenciais em Termodinâmica, para processos irreversíveis a sua natureza controversa tem originado intenso debate na literatura1-10 e em livros de texto.11-13 Contudo, ainda subsistem algumas questões interessantes em aberto que requerem clarificação. Especificamos a seguir os três principais tópicos que nos propomos explorar neste artigo. Na literatura4 somos confrontados muitas vezes com duas definições de calor e trabalho: uma baseada no sistema e a outra baseada na vizinhança. Alguns autores defendem que ambas as definições podem ser utilizadas para desenvolver a Termodinâmica, sendo a questão central saber qual destas duas definições é mais geral e mais facilmente aplicável;4 outra questão a clarificar é o significado das expressões Qsis = - Qviz e Wsis = - Wviz, que se encontram também na literatura,4 onde os subscritos "sis" e "viz" significam sistema e vizinhança, respectivamente; finalmente, a questão da invariância do calor e do trabalho relativamente à permuta entre sistema e vizinhança.
O objectivo deste trabalho é analisar as questões referidas acima. Com este propósito em mente, começaremos por discutir as definições de calor e de trabalho. Utilizando argumentos lógicos e o conceito de processos termodinâmicos idênticos1,6 concluímos que o calor e trabalho têm significados físicos específicos que levam a definições inequívocas. Clarificaremos também a segunda questão no contexto das novas definições de calor e trabalho. Seguidamente, apresentaremos dois processos termodinâmicos e consideraremos para cada um deles uma transformação que consiste numa permuta entre sistema e vizinhança. Mostra-se que o conceito de processos idênticos, o qual está intimamente ligado à Segunda Lei, implica que calor e trabalho não podem, em geral, ser invariantes sob tal transformação.
SOBRE AS DEFINIÇÕES DE CALOR E TRABALHO
Os conceitos de calor e trabalho são efectivamente fundamentais em Termodinâmica, não só porque representam mecanismos conceptualmente diferentes de transferência de energia entre o sistema e a sua vizinhança, mas também porque eles são elementos chave para a formulação das leis da Termodinâmica, nomeadamente da Primeira e Segunda Leis.
Para descrever e analisar um processo termodinâmico, é necessário começar por definir o sistema em estudo e explicitar as propriedades da fronteira que o separa da sua vizinhança. A vizinhança é uma região externa ao sistema, a qual interage directa ou indirectamente com ele (Figura 1). Esta explicitação inicial é crítica para a descrição do processo em estudo. As definições do sistema, da fronteira e da vizinhança são algumas vezes implícitas na formulação de problemas de Termodinâmica, o que constitui uma dificuldade adicional para os alunos.
De um ponto de vista conceptual e lógico, uma vez definido o sistema e as propriedades da fronteira estabelecidas, então para um dado processo termodinâmico, Q e W devem ter valores fixos, independentemente do método utilizado para os determinar. A hipótese de Q e W terem valores diferentes consoante o procedimento utilizado para a sua determinação é inaceitável. Com efeito, tal ambiguidade implicaria que calor e trabalho se tornassem conceitos marginais e inúteis, pois, para além de não serem funções de estado, não seriam agora também funções de processo.2 Consequentemente, poderíamos questionar a relevância dos conceitos de calor e trabalho para a formulação da Primeira e Segunda Leis.
Para qualquer processo que ligue os mesmos estados inicial e final, a Primeira Lei estabelece que a soma Q + W é um invariante, o qual é designado por variação da energia interna, ΔU, ou seja,
A lei acima permite a utilização de diferentes definições de calor e trabalho sob a única condição de que a sua soma permaneça constante. É esta vulnerabilidade intrínseca da Primeira Lei que dá suporte à ideia de que calor e trabalho podem ter mais do que uma definição sem que tal conduza à perda de consistência do ponto de vista termodinâmico.2
Pelo contrário, a conhecida relação de Clausius para processos cíclicos, a qual constitui uma formulação da Segunda Lei,
requer uma definição única de calor, porque esta relação não exibe a simetria da Primeira Lei. Tal definição única está de acordo com o conceito de processos termodinâmicos idênticos.1,6 Processos termodinâmicos idênticos são processos intermutáveis no sentido de que eles ligam os mesmos estados inicial e final e produzem efeitos equivalentes na vizinhança. Uma consequência desta definição é que não é possível determinar, por mera inspecção das propriedades do sistema e da vizinhança nos seus estados finais, qual foi o processo, de entre um conjunto de processos idênticos, que efectivamente teve lugar. A condição de identidade de processos é a invariância da grandeza  δQ/Te, podendo a relação de Clausius (2) ser obtida a partir do conceito de processos idênticos. A invariância de
δQ/Te, podendo a relação de Clausius (2) ser obtida a partir do conceito de processos idênticos. A invariância de  δQ/Teconduz a uma definição única e objectiva de calor,6
δQ/Teconduz a uma definição única e objectiva de calor,6
onde o subscrito "e" denota uma variável externa ao sistema, pelo que Se representa a entropia do reservatório de calor à temperatura Te, com o qual o sistema troca o calor δQ. Por integração da Equação 3 obtemos um valor bem definido para Q o qual, em conjunto com o valor constante de ΔU na Equação 1, conduz também a um valor único para o trabalho.
É importante também referir que calor e trabalho consistem em transferências de energia através da fronteira, sendo ambos funções de processo. Uma vez que a energia não é criada nem destruída na fronteira, e também não ocorrem nesta fronteira transformações de energia, o calor que sai (ou entra) da (na) vizinhança Qviz, tem o mesmo valor absoluto daquele que entra (ou sai) no (do) sistema Qsis, ou seja, Qviz = - Qsis. Uma conclusão análoga pode ser obtida para o trabalho, isto é, Wviz = - Wsis.
É pertinente referir que as conclusões acima são frequentemente relacionadas na literatura com as diferentes formas de definir calor e trabalho.4 Contudo, deve ser realçado que tal relação não existe, pois quer o calor quer o trabalho têm definições únicas.
Deve ser notado que enquanto que δQ é obtido utilizando variáveis termodinâmicas do reservatório de calor (Equação 3), δW é obtido utilizando variáveis termodinâmicas do reservatório de trabalho que interage com o sistema, ou seja,
onde Ye é designado por força generalizada e dXe é a diferencial do deslocamento generalizado.12
A forma diferencial da Primeira Lei pode então ser escrita a partir das Equações 3 e 4 como
A Equação 5 expressa dU em função de variáveis dos reservatórios de calor e trabalho. Em alternativa, podemos expressar dU em função das mesmas variáveis mas agora referidas ao sistema, ou seja,
Vale a pena sublinhar que a Equação 6 não expressa a Primeira Lei porque, em geral, temos δQ ≠TdS e δW ≠ YdX, excepto para alguns processos particulares, incluindo os reversíveis.
Combinando as Equações 5 e 6, obtemos
Na equação acima, δQ = - TedSe e δW = YedXe são, respectivamente, o calor e o trabalho trocados. A quantidade δWD = YedXe + YdX é o trabalho dissipativo. Portanto, o trabalho total trocado, dado por δW = YedXe é a soma do trabalho de configuração -YdX com o trabalho dissipativo. Portanto, da literatura,4 a definição de trabalho baseada na vizinhança, YedXe, corresponde ao trabalho total, enquanto que a definição baseada no sistema, -YdX, corresponde apenas ao trabalho de configuração. Uma vez que não há trabalho dissipativo para processos reversíveis, neste caso o trabalho total é igual ao trabalho de configuração.
Para todos os processos reversíveis, e para os processos irreversíveis onde o trabalho dissipativo é zero, temos que
e utilizando as Equações 7 e 8 obtemos também
Sempre que as Equações 8 e 9 sejam verificadas, as variáveis do reservatório de calor (Te e Se) e do reservatório de trabalho (Ye e Xe) são permutáveis com as variáveis do sistema correspendentes (T e S) e (Y e X). Conceptualmente, isto é equivalente a uma permuta entre o sistema e a vizinhança. Se, adicionalmente, T = Te, da Equação 9 obtém-se dS + dSe = 0 e o processo não dissipativo é reversível, sendo importante salientar que a condição T = Te não obriga a que tal processo seja também isotérmico. Com efeito, descrevendo as Equações 8 e 9 processos infinitesimais, a reversibilidade dos processos no interior de um reservatório de calor apenas requer que a sua temperatura Te seja espacialmente invariante num dado instante, existindo duas formulações equivalentes para descrever este tipo de processos reversíveis não isotérmicos. A formulação adoptada por Zemansky et al.12 considera que o sistema é posto em contacto com sucessivos reservatórios de calor cada um dos quais caracterizado por uma temperatura espacial e temporalmente invariante, enquanto que a formulação adoptada por Callen13 considera que o sistema é posto em contacto com um único reservatório de calor cuja temperatura é espacialmente invariante mas podendo variar no tempo.
Ainda antes de concluir esta secção é importante referir que do ponto de vista físico o calor e o trabalho são, respectivamente, manifestações do movimento caótico e organizado das partículas na vizinhança,1,2,6 pelo que uma alteração na vizinhança resultante da sua permuta com o sistema poderá ter como consequência uma alteração dos valores do calor e do trabalho, mantendo-se contudo invariante a sua soma. Tais alterações serão analisadas na secção seguinte, com a apresentação de dois exemplos.
PERMUTA ENTRE O SISTEMA E VIZINHANÇA
Nos exemplos que se apresentam a seguir, começaremos por definir o sistema e considerar um processo termodinâmico para o qual determinaremos calor e trabalho. Faremos a seguir uma permuta entre o sistema e a vizinhança para mostrar que, para o primeiro exemplo, calor e trabalho não são invariantes sob tal transformação, enquanto que para o segundo exemplo tal invariância é verificada.
Exemplo 1
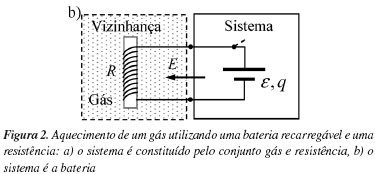
Consideremos um sistema formado por um gás e por uma resistência eléctrica R encerrado num recipiente com paredes rígidas. O sistema tem massa m e capacidade térmica mássica c. A vizinhança é formada por uma bateria recarregável caracterizada por uma carga q e uma força electromotriz e. Inicialmente, o sistema está num estado de equilíbrio à temperatura Ti. Ligando a resistência à bateria durante um certo intervalo de tempo Δt, uma quantidade de energia E é transferida da vizinhança para o sistema, e como resultado a temperatura do sistema aumenta para um valor Tf. Assumimos que os valores de R e ε são tais que o processo de aquecimento é muito lento, de forma que durante todo o processo o sistema está sempre em equilíbrio termodinâmico a uma dada temperatura T. O processo está ilustrado na Figura 2a.
Como se assume que a bateria é ideal e recarregável, no seu interior não ocorrem irreversibilidades e a sua entropia permanece constante, obtendo-se da Equação 3
Além disso, durante o intervalo de tempo dt, a energia dE transferida da vizinhança para o sistema é dada por
onde I é a corrente eléctrica, e o sinal negativo resulta da variação infinitesimal da carga na bateria dq ser negativa, isto é, - dq = Idt.
Uma vez que dQ = 0, pela Primeira Lei e pela Equação 4 temos
i.e., a força generalizada Ye pode ser considerada aqui como a força electromotriz da bateria e, e a diferencial do deslocamento generalizado dXe pode ser tomado como - dq.
Em conclusão, numa perspectiva termodinâmica, a energia dE transferida é identificada como o trabalho δW. Como a força electromotriz ε e a carga q, que caracterizam a bateria recarregável, não têm variáveis correspondentes no sistema (a bateria é o elemento activo, enquanto que a resistência é o elemento passivo), a Equação 8 nunca pode ser satisfeita, ou seja, para este exemplo o trabalho dissipativo δWD não pode ser zero, e portanto o trabalho total é trabalho dissipativo.
Embora na situação descrita na Figura 2a não exista troca de calor entre o sistema e a vizinhança (Q = 0) este deixa de ser o caso se procedermos a uma permuta entre o sistema e a vizinhança (Figura 2b). No entanto, antes de analisarmos em detalhe esta última situação, é importante realçar que a parede sistema-vizinhança é invariante na permuta, o que levanta a questão da aplicabilidade do conceito de parede adiabática às situações retratadas nas Figuras 2a e 2b. Com efeito, o conceito de parede adiabática (entendida como inibidor da troca de calor) só se aplica a processos de transferência de calor por condução na presença de um gradiente de temperatura, o que não acontece no presente exemplo.
Com a nova definição do sistema, decorrente da permuta conceptual sistema-vizinhança (Figura 2b), a entropia da vizinhança varia agora durante o processo. Então, de acordo com a Equação 3, a energia transferida para a vizinhança é agora identificada como calor, o qual é dado por
Com a permuta sistema-vizinhança a energia trocada é dada pelo simétrico da Equação 11, e temos então δQ = εdq = ε2dt/R. Contudo, como a força electromotriz ε e a carga q são agora propriedades do sistema, não podemos utilizá-las para decidir se a troca de energia é calor ou trabalho, pois apenas as variáveis externas ao sistema o permitem fazer (ver Equações 3 e 4). Consequentemente, a energia trocada consiste unicamente em calor, e o trabalho trocado é portanto zero
Em conclusão, uma vez que as Equações 8 e 9 não se verificam para este exemplo, calor e trabalho não são invariantes sob uma permuta entre o sistema e a vizinhança, o que está em consonância com a necessidade de uma definição clara do sistema.
Exemplo 2
Consiste num corpo A de massa mª e de capacidade térmica mássica cª. O sistema está inicialmente à temperatura T2 e é colocado em contacto térmico com outro corpo B, de massa mB, capacidade térmica mássica cB e à temperatura T1, sendo T1 > T2. A vizinhança é constituída pelo corpo B e pela atmosfera envolvente à pressão constante Patm. A situação está representada na Figura 3a.
Uma vez estabelecido o contacto térmico, ocorre troca de calor por condução do corpo B para o corpo A, e troca de trabalho por expansão do corpo A e contracção do corpo B (assumindo que ambos têm coeficientes de expansão térmicos positivos). A força generalizada Ye pode ser tomada aqui como Pe, e a diferencial do deslocamento generalizado dXe pode ser tomada como dVe. Para este processo, o sistema e a vizinhança estão sujeitos à mesma pressão, P = Pe= Patm, e sofrem variações de volume da mesma grandeza mas sinais opostos,
o que nos permite escrever
A equação acima implica que as Equações 8 e 9 sejam agora verificadas e, consequentemente, espera-se que calor e trabalho sejam invariantes para uma permuta sistema-vizinhança. Tanto o sistema como a vizinhança sofrem variações na sua entropia, e pela Equação 3, assumindo que a troca de calor entre os corpos e a atmosfera é desprezável, obtemos
Utilizando a temperatura final de equilíbrio, ou seja,
e assumindo que ΔV<<V, integrando as Equações 16 e 17 obtém-se
onde β = (1/V)(∂V/∂T)P é o coeficiente de expansão térmica isobárico.
Devido ao carácter simétrico da Equação 19, uma permuta do sistema (A) com a vizinhança (B + atmosfera) apenas resulta numa troca de sinal de Q e, devido à invariância de Q + W, também numa troca de sinal de W.
CONCLUSÃO
Argumentou-se neste trabalho que os invariantes decorrentes da Primeira Lei e do conceito de processos idênticos conduzem a uma definição única para calor e trabalho.
Consistente com o conceito de processos termodinâmicos idênticos, foram dados dois exemplos para ilustrar respectivamente que, para o caso de trabalho dissipativo diferente de zero, calor e trabalho não são invariantes para uma permuta sistema-vizinhança, enquanto que na ausência de trabalho dissipativo tal invariância está presente. Este trabalho dissipativo é precisamente a diferença entre as duas definições de trabalho que algumas vezes são referidas na literatura, nomeadamente a definição baseada na vizinhança e a definição baseada no sistema. Para além disso, os valores do calor e trabalho referidos ao sistema são simétricos dos valores referidos à vizinhança, embora deva ser realçado que esta relação não tem nada a ver com processos diferentes de determinar calor e trabalho, sendo unicamente uma consequência da conservação da energia.
Estas ideias são relevantes pois contribuem para a clarificação de algumas dificuldades de interpretação encontradas na literatura, para além de terem também interesse pedagógico.
Recebido em 10/6/07; aceito em 28/3/08; publicado na web em 1/10/08
- 1. Anacleto, J.; Ferreira, J. M.; Anacleto, A.; Can. J. Phys. 2008, 86, 369.
- 2. Anacleto, J.; Ferreira, J. M.; J. Chem. Termodynamics 2008, 40, 134.
- 3. Anacleto, J.; Anacleto A.; Quim. Nova 2007, 30, 488.
- 4. Gislason, E. A.; Craig, N. C.; J. Chem. Thermodynamics 2005, 37, 954.
- 5. Anacleto, J.; Rev. Bras. Ens. Fis. 2005, 27, 259.
- 6. Anacleto, J.; Can. J. Phys. 2005, 83, 629.
- 7. Besson, U.; Eur. J. Phys. 2003, 24, 245.
- 8. Craig, N. C.; Gislason, E. A.; J. Chem. Educ. 2002, 79, 193.
- 9. Moreira, N. H.; Bassi, A. B. M. S.; Quim. Nova 2001, 24, 536.
- 10. Gislason, E. A.; Craig, N.C.; J. Chem. Educ. 1987, 64, 660.
- 11. Sonntag, R. E.; Borgnakke, C.; Van Wylen, G. J.; Fundamentals of Thermodynamics, 6th ed., John Wiley: New York, 2003.
- 12. Zemansky, M. W.; Dittman R. H.; Heat and Thermodynamics, 6th ed., McGraw-Hill: Auckland, 1997.
- 13. Callen, H. B.; Thermodynamics and an introduction to thermostatistics, 2nd ed., John Wiley: New York, 1985.
Datas de Publicação
-
Publicação nesta coleção
09 Dez 2008 -
Data do Fascículo
2008
Histórico
-
Aceito
28 Mar 2008 -
Recebido
10 Jun 2007