Resumos
A injeção percutânea de etanol (IPE) guiada por ultra-som tem sido utilizada para o tratamento de nódulos tiroidianos autônomos, sólidos e císticos. Apresentamos nossa experiência em 50 pacientes tratados, sendo 26 portadores de nódulos sólidos, 17 de nódulos císticos e 7 de nódulos autônomos (NA). Avaliamos os pacientes 1 semana, 1 mês, 3 meses, 6 meses e 1 ano após a IPE. Após 1 ano, os nódulos sólidos reduziram a 74% do volume inicial, os císticos diminuíram 92% sem apresentar recidivas. Um ano após o tratamento dos nódulos autônomos, 5 pacientes estavam em eutiroidismo clínico e laboratorial e 2 em eutiroidismo mas com TSH subnormal. Não houve recorrência da tirotoxicose e a redução nodular foi de 66%. O procedimento foi bem tolerado por todos. Os resultados confirmam que a IPE é uma boa alternativa terapêutica para redução dos nódulos tiroidianos císticos e sólidos e no tratamento dos nódulos autônomos.
Etanol; Nódulo tiroidiano; Ultrassonografia; Escleroterapia; Hipertiroidismo
Percutaneous ethanol injection (PEI) guided by ultrasound has been used for the treatment of cystic, solid and autonomous thyroid nodules. We present our experience in the treatment of 50 patients with thyroid nodules: 26 solid, 17 cystic and 7 autonomous (AN). Patients were evaluated 1 week, 1, 3, and 6 months and 1 year after PEI. After one year, solid nodules showed a mean 74% volume reduction, and cysts a volume reduction of 92%, with no recurrences. After one year, 5 patients with AN reached clinical and laboratory euthyroidism; the other 2 also became euthyroid, but with subnormal TSH. Recurrence of thyrotoxicosis was not observed and mean nodular reduction was 66%. The procedure was well tolerated by all patients. The results confirm that PEI is a good therapeutic alternative for reduction of solid and cystic thyroid nodules and for the treatment of autonomous nodules.
Ethanol; Thyroid nodule; Interventional ultrasonography; Sclerotherapy; Thyrotoxicosis
ARTIGO ORIGINAL
Injeção percutânea de etanol no tratamento de nódulos tiroidianos sólidos, císticos e autônomos
Percutaneous ethanol injection for treatment of solid, cystic and autonomous thyroid nodules
Elizabeth X. Bianchini; Elza S. Ikejiri; Maria Conceição Mamone; Elias R. Paiva; Rui M.B. Maciel; Reinaldo P. Furlanetto
Disciplina de Endocrinologia, Departamento de Medicina, Escola Paulista de Medicina, Universidade Federal de São Paulo, São Paulo, SP.
Endereço para correspondência Endereço para correspondência Elizabeth Xavier Bianchini Disciplina de Endocrinologia, Departamento de Medicina Escola Paulista de Medicina, Universidade Federal de São Paulo Rua Pedro de Toledo 781, 12º. andar 04033-032 São Paulo, SP Fax: (011) 5084-5231 e.mail: exbbianchini@directnet.com.br
RESUMO
A injeção percutânea de etanol (IPE) guiada por ultra-som tem sido utilizada para o tratamento de nódulos tiroidianos autônomos, sólidos e císticos. Apresentamos nossa experiência em 50 pacientes tratados, sendo 26 portadores de nódulos sólidos, 17 de nódulos císticos e 7 de nódulos autônomos (NA). Avaliamos os pacientes 1 semana, 1 mês, 3 meses, 6 meses e 1 ano após a IPE. Após 1 ano, os nódulos sólidos reduziram a 74% do volume inicial, os císticos diminuíram 92% sem apresentar recidivas. Um ano após o tratamento dos nódulos autônomos, 5 pacientes estavam em eutiroidismo clínico e laboratorial e 2 em eutiroidismo mas com TSH subnormal. Não houve recorrência da tirotoxicose e a redução nodular foi de 66%. O procedimento foi bem tolerado por todos. Os resultados confirmam que a IPE é uma boa alternativa terapêutica para redução dos nódulos tiroidianos císticos e sólidos e no tratamento dos nódulos autônomos.
Descritores: Etanol; Nódulo tiroidiano; Ultrassonografia; Escleroterapia; Hipertiroidismo
ABSTRACT
Percutaneous ethanol injection (PEI) guided by ultrasound has been used for the treatment of cystic, solid and autonomous thyroid nodules. We present our experience in the treatment of 50 patients with thyroid nodules: 26 solid, 17 cystic and 7 autonomous (AN). Patients were evaluated 1 week, 1, 3, and 6 months and 1 year after PEI. After one year, solid nodules showed a mean 74% volume reduction, and cysts a volume reduction of 92%, with no recurrences. After one year, 5 patients with AN reached clinical and laboratory euthyroidism; the other 2 also became euthyroid, but with subnormal TSH. Recurrence of thyrotoxicosis was not observed and mean nodular reduction was 66%. The procedure was well tolerated by all patients. The results confirm that PEI is a good therapeutic alternative for reduction of solid and cystic thyroid nodules and for the treatment of autonomous nodules.
Keywords: Ethanol; Thyroid nodule; Interventional ultrasonography; Sclerotherapy; Thyrotoxicosis
A INJEÇÃO PERCUTÂNEA DE ETANOL guiada por ultra-som (IPE) foi iniciada em 1985 com o objetivo de tratar cistos renais, pequenos carcinomas hepatocelulares e hiperplasias e adenomas da paratiróide (1-3). Em 1990, Livraghi e cols. (4) propuseram seu uso para o tratamento de nódulos tiroidianos autônomos hiperfuncionantes e obtiveram regressão anatômica das lesões e cura da disfunção glandular. Na última década, vários grupos, especialmente europeus, têm confirmado os bons resultados desta terapia, tanto em nódulos tóxicos como atóxicos (5-7).
A IPE apresenta resultados superiores à aspiração simples e à aspiração seguida do uso de outras substâncias esclerosantes no tratamento de cistos tiroidianos (8-11), causa índice baixo de recidivas e foi sugerida como a primeira alternativa para o tratamento de cistos recorrentes (12), apresentando redução do volume nodular variável de 45,5 a 96,3% e índice mínimo de efeitos colaterais (13-16).
O mecanismo de ação do etanol absoluto deve-se a seu efeito esclerosante, causador de hemorragia tecidual e necrose de coagulação, seguida de fibrose (17,18). Os efeitos colaterais da injeção do etanol são descritos, nas várias séries, de fracos a moderados e são sempre transitórios, sendo a dor local no momento da aplicação o principal sintoma (4,19-21).
Neste estudo, apresentamos nossos resultados obtidos com o uso de IPE guiada por ultra-sonografia cervical (US) no tratamento de nódulos tiroidianos sólidos, císticos e autônomos (tóxicos e atóxicos), e analisamos seus efeitos sobre o volume nodular e função tiroidiana, assim como suas reações colaterais e complicações.
PACIENTES E MÉTODOS
Pacientes
Entre 1997 e 1999, tratamos 50 pacientes portadores de nódulos tiroidianos, selecionados do Ambulatório de Tiróide da Disciplina de Endocrinologia, Departamento de Medicina, Escola Paulista de Medicina, Universidade Federal de São Paulo (UNIFESP). O protocolo de pesquisa foi submetido à avaliação pela Comissão de Ética Médica do Hospital São Paulo-UNIFESP, e aprovado integralmente; os pacientes leram e assinaram a carta de informação e o termo de consentimento.
Os pacientes pertenciam a 3 grupos de doença nodular: nódulos sólidos (n= 26), nódulos císticos (puros ou mistos) (n= 17) e nódulos autônomos (n= 7; 6 sólidos e 1 misto), 5 dos quais eram tóxicos (NT) e 2 atóxicos (NAA).
Os critérios de inclusão e exclusão para os 3 diferentes tipos de nódulos foram os seguintes:
a) Nódulos sólidos e císticos: Critérios de inclusão: quadro clínico de eutiroidismo; níveis normais de TSH e T4L; diagnóstico de nódulo benigno à citologia na punção aspirativa por agulha fina (PAAF); nódulo palpável com sintomas compressivos ou queixas estéticas; pacientes com indicação cirúrgica, porém com risco cirúrgico desfavorável ou que se recusaram a submeter-se à cirurgia; nódulo dominante em bócios multinodulares que se incluam nas condições acima. Critérios de exclusão: malignidade ou suspeita de malignidade na PAAF; material insuficiente para diagnóstico após duas PAAFs; pacientes sem queixas estéticas ou compressivas e recusa do paciente a submeter-se ao tratamento proposto.
b) Nódulos autônomos: Critérios de inclusão: quadro clínico de tirotoxicose (NT) ou eutiroidismo (NAA); TSH suprimido e T4L elevado nos NT e TSH suprimido ou subnormal com T4L normal nos NAA; cintilografia tiroidiana demonstrando concentração do traçador radiativo no nódulo, com supressão do restante do parênquima glandular. Critérios de exclusão: presença de múltiplas áreas focais de autonomia glandular; bócio mergulhante; pacientes com dosagem de anticorpo anti-receptor de TSH (TRAb) positivo e recusa do paciente a submeter-se ao tratamento proposto.
Métodos
Técnica para a escleroterapia com etanol: Realizamos a injeção de etanol absoluto (99,8%) em condições satisfatórias de assepsia, sem anestesia local, com o auxílio de agulha calibre 22 (Becton Dickinson 30 x 7) dirigida por US até o ponto central da lesão (22,23). Monitoramos as injeções por meio da observação ao US, para evitar o escape extranodular e permitir a otimização da difusão do etanol (4,24). Nos nódulos sólidos, a quantidade de etanol injetada em cada sessão dependeu do volume do nódulo, correspondendo a cerca de 20-30% do volume nodular calculado previamente. Nos pacientes com nódulos císticos, aspiramos o componente líquido e, sem necessidade da retirada da agulha, substituímos a seringa do material aspirado pela seringa com etanol, injetamos o volume correspondente a 30-50% do volume de líquido retirado e, após 10-15 minutos, reaspiramos o etanol injetado (9,10). Nos nódulos mistos, aspiramos a porção líquida guiados pelo US, recalculamos o volume nodular e realizamos o mesmo procedimento aplicado nos nódulos sólidos.
Realizamos as injeções em intervalos semanais nos nódulos autônomos e quinzenais nos nódulos sólidos e mistos. O número de sessões dependeu do volume de etanol a ser injetado. Observamos que, quanto menor volume injetado por sessão, menor a dor referida pelo paciente. Optamos por injeções semanais nos nódulos autônomos devido à necessidade de levar o paciente ao eutiroidismo o mais rapidamente possível, diminuindo o tempo de tratamento.
Seguimento: Antes da escleroterapia, realizamos a PAAF diagnóstica guiada por US de todos os nódulos (25,26); realizamos também o US antes da escleroterapia para o cálculo do volume do nódulo e a estimativa do volume de etanol a ser utilizado (26,27). Também realizamos a cintilografia tiroidiana antes e 3 a 6 meses após o final do tratamento, ou no momento em que houve o desbloqueio do TSH. Avaliamos os pacientes com nódulos sólidos e císticos com dosagens basais de TSH e T4L e 1, 3, 6 e 12 meses depois da IPE; os pacientes com nódulos autônomos foram avaliados com dosagens de TSH e T4L basais, e após 1 semana, 1, 3, 6 e 12 meses do término do tratamento. Calculamos o volume do nódulo ao US antes e depois da escleroterapia nos tempos 1 semana e 1, 3, 6 e 12 meses. Consideramos recidiva o crescimento do nódulo tratado após o término do tratamento.
Avaliação Diagnóstica: TSH: método imunofluorimétrico com nível de sensibilidade de 0,05UI/L e valores de referência entre 0,3 e 4,5UI/L (29). T4L: método imunofluorimétrico utilizando-se "kit" comercial (AutoDELFIA FT4, Wallac Oy, Turku, Finlândia), valores de referência: 0,6-1,5ng/dL. O exame ultra-sonográfico foi realizado no Ambulatório de Endocrinologia da UNIFESP, sempre pelo mesmo examinador (ESI), utilizando aparelho ALOKA 500 de alta resolução com transdutor linear de 7,5MHz. Calculamos o volume do nódulo através da fórmula para estruturas elipsóides: comprimento x largura x espessura x 0,52 (mL) (25,26,28). Obtivemos o percentual de redução do volume nodular pela fórmula:
Cintilografia: as cintilografias de tiróide foram realizadas com 2 aparelhos: (i) Gama-câmara Elscint SPX-4, acoplada a um computador para processamento das imagens, equipada com colimador de furos paralelos, de baixa energia. O fotópico foi centrado na energia de 140Kev do tecnécio, com janela simétrica de 10%. Adquiriram-se imagens estáticas da região anterior do pescoço 20min após a injeção endovenosa do tecnécio na forma de pertecnetato; (ii) Gama-câmara planaCaptus com sonda de detecção específica para medidas de captação, utilizando 123I como radiotraçador.
Cada paciente foi examinado sempre no mesmo aparelho.
Análise Estatística: Utilizamos o teste de Friedman para análise das variações do volume nodular, percentual de redução nodular (DV%), TSH e T4L e consideramos como nível de significância p<0,05 (5%). O teste exato de Fisher foi o método utilizado para correlação.
RESULTADOS
Nódulos Sólidos
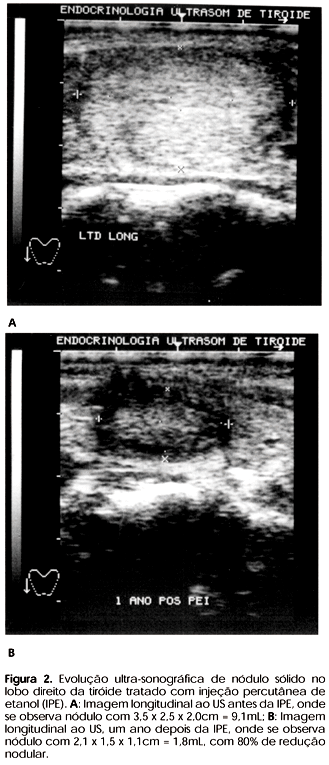
O volume de etanol injetado por sessão variou de 0,7 a 5,3mL (Mi= 2,0mL) em 3 a 8 sessões por paciente (Mi= 5 sessões). O volume nodular inicial variou de 1,4 a 36,3mL (Mi= 7,8mL) e houve redução significante do volume durante o seguimento (p<0,0001), assim distribuída: após 1 mês, de 0,5 a 15,9mL (Mi= 3,7mL); após 3 meses, de 0,5 a 12,9mL (Mi= 2,9mL); após 6 meses, de 0,3mL a 10,6mL (Mi= 2,2mL); e após 1 ano, de 0,3 a 14,1mL (Mi= 1,7mL) (figuras 1 e 2).
O percentual de redução do volume nodular (DV%) após 1, 3, 6 e 12 meses do tratamento com IPE foi de 50%, 54%, 67% e 74%, respectivamente (p<0,0001). A maior diferença percentual de volume ocorreu nos períodos compreendidos entre o início e 1 mês após o tratamento (50%) (figura 3).
Houve variação significante na concentração do TSH durante o período de seguimento (p=0,002). O TSH aumentou em 3 pacientes, seguido de normalização cerca de 3 a 6 meses após o tratamento com a IPE. Por outro lado, a concentração de T4L não variou ao longo do tempo depois da IPE, permanecendo dentro dos valores normais também naqueles 3 pacientes que mostraram alteração na concentração de TSH.
Não observamos correlação significante entre o volume inicial dos nódulos e a correspondente percentagem de redução nodular final. Também não observamos correlação entre o volume de etanol injetado por mL de nódulo com a percentagem de redução nodular.
Nódulos Císticos
Dos 17 pacientes tratados, 2 eram portadores de cistos puros, 11 tinham nódulos mistos predominantemente císticos e 4 tinham nódulos predominantemente sólidos. O volume de líquido aspirado por nódulo variou de 1,5 a 40mL (Mi= 5,5mL). Cinco pacientes (24%) necessitaram de mais de uma aspiração devido à recorrência de parte do conteúdo cístico; nestas circunstâncias, o volume retirado na segunda aspiração foi, invariavelmente, menor que o conseguido na primeira. Apenas uma paciente necessitou de 3 aspirações consecutivas. O volume de etanol injetado por sessão variou de 0,8 a 5,4mL (Mi= 2,4mL) e o número de sessões por paciente de 1 a 9 (Mi = 4).
O volume nodular inicial variou de 3,4 a 41,6mL (Mi= 10,9mL), com redução significante após a IPE (p<0,0001). Um mês depois da última IPE, o volume nodular variou de 0,8 a 16,6mL (Mi= 1,9mL), 3 meses depois de 0,4 a 12,3mL (Mi= 1,4mL), 6 meses depois de zero a 10,8mL (Mi= 1,3mL) e 12 meses depois de zero a 9,2mL (Mi= 1,0mL) (figura 1).
A percentagem de redução nodular ao longo do tempo foi estatisticamente significante (p<0,0001). Após 1, 3, 6 e 12 meses da IPE, o percentual de redução foi de 83%, 88%, 90% e 92%, respectivamente (figuras 3 e 4). Nenhum paciente apresentou recidiva durante o seguimento.
Não houve variação significante na concentração de TSH ao longo do período de estudo. O TSH elevou-se em 3 pacientes, todos com normalização após 3 a 6 meses. Por outro lado, a concentração de T4L não variou durante o seguimento, permanecendo dentro dos limites da normalidade em todos os pacientes.
Não houve correlação significante entre o volume basal dos nódulos e a correspondente percentagem de redução obtida com a IPE. Também não observamos correlação significante entre o volume de líquido aspirado ou o volume de etanol injetado em cada nódulo com a percentagem de redução nodular depois da IPE.
Nódulos Autônomos
Nos pacientes com NA tóxicos e atóxicos, o volume de etanol injetado variou de 0,9 a 7,0mL por sessão (Mi= 2,7mL), tendo sido feitas de 5 a 10 sessões por paciente (Mi= 6). Quatro pacientes com NT apresentavam sinais e sintomas de tirotoxicose, que desapareceram aproximadamente 20 dias após a primeira injeção, sendo que uma delas estava em eutiroidismo pelo uso de antitiroidiano, suspenso 30 dias após o início da IPE.
Antes do tratamento, a concentração basal de TSH era indetectável em 5 pacientes e subnormal em 2, dos quais 1 em uso de antitiroidianos. Após a IPE, houve variação estatisticamente significante ao longo do tempo (p=0,0058). Assim, o TSH já se apresentou normal em 3 pacientes logo uma semana após a última injeção da IPE, e em 6 pacientes após 1 mês. Um paciente cursou com hipotiroidismo sub-clínico (eutiroidismo clínico com TSH acima dos valores normais e T4L normal) a partir do terceiro mês, permanecendo assim cerca de 1 ano após o tratamento; o seguimento desse paciente por tempo mais prolongado evidenciou a quase normalização do valor de TSH (5,1UI/L), 18 meses após a IPE. Antes da IPE, a concentração de T4L estava elevada em 4 pacientes e normal em 3, 2 dos quais com nódulos atóxicos e 1 em uso de antitiroidiano. Uma semana após a última injeção, a concentração de T4L estava normal em 6 pacientes e subnormal em 1; 3 pacientes tiveram, transitoriamente, níveis de T4L abaixo dos limites normais cerca de 3 meses após a IPE. Todos normalizaram os valores de T4L no seguimento.
O volume nodular inicial variou de 1,3 a 98,2mL (Mi= 12,5mL) (figura 1). Houve redução significante do volume nodular após a IPE (p<0,0001). Um mês após a IPE, o volume variou de 0,8 a 73,2mL (Mi= 5,0mL), 3 meses após de 0,4 a 64mL (Mi= 5,2mL), 6 meses após de 0,4 a 56,4mL (Mi= 3,6mL) e 12 meses após de 0,5 a 33,8mL (Mi= 1,9ml) (figura 1). O percentual de redução nodular foi significante, sendo 42% um mês depois da IPE, 63% aos 3 meses, 64% aos 6 meses e 66% 12 meses após a IPE (figura 3).
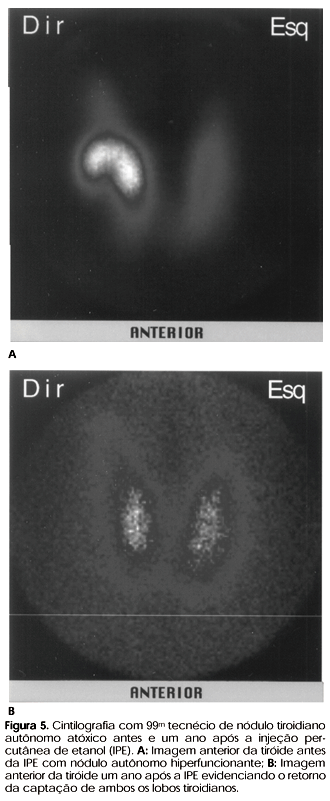
Em todos os pacientes com NT houve restauração da captação na cintilografia realizada ao final de um ano de tratamento; um paciente com NAA teve normalização da cintilografia (figura 5) e outro paciente com NAA apresentou recuperação parcial da captação glandular após um ano da IPE.
Efeitos Colaterais
A IPE foi bem tolerada, sem interrupção do tratamento em nenhum paciente. O sintoma mais freqüente foi dor no local da injeção, que persistiu por 10 a 30 minutos, permanecendo ou não sensibilidade na região cervical por 12 a 24 horas.
Após a IPE, 5 pacientes (10%) evoluíram com rouquidão, 2 deles com resolução em 30min, 2 em 48hs e outro em uma semana. Três pacientes (6%) apresentaram febre por 24 a 48hs; hematoma local ocorreu em outros 6 pacientes (12%). Não houve rouquidão, febre ou hematoma nos pacientes com cistos tratados com IPE. Hipotiroidismo transitório ocorreu em 7 (14%) dos 50 pacientes tratados, sendo 1 com NT, 3 com nódulos sólidos e 3 com cistos tiroidianos.
DISCUSSÃO
Adotando-se o critério de redução de pelo menos 50% do volume nodular como sucesso terapêutico para os nódulos sólidos, obtivemos esse resultado em 13 dos 26 pacientes (50%), um mês após o final da IPE e em 24 pacientes (92%) após 6 meses.
O percentual de redução do volume nodular ao fim de um ano de tratamento variou de 29 a 94% (Mi= 74), resultado equivalente ao de Caraccio e cols. (14), que obtiveram redução de 45,6 a 96,3% (Mi= 73,2) em 54 pacientes tratados com IPE.
Dois dos 26 pacientes tiveram redução nodular até o sexto mês de seguimento mas apresentaram, posteriormente, aumento discreto, embora um ano após a IPE permanecessem com volume de 29% e de 48% em relação ao volume inicial.
O sucesso terapêutico nos nódulos císticos (considerado como uma redução de 50% ou mais em relação ao volume inicial), foi obtido uma semana após o final da IPE em 15 de 17 pacientes (88%) e em todos os pacientes após 3 meses. Verde e cols. (10) compararam os resultados da aspiração simples e da escleroterapia com etanol nos nódulos císticos, e confirmaram melhores resultados com a IPE, havendo apenas uma recidiva em 32 pacientes contra 80% de recidiva no grupo tratado com aspiração simples.
É referido na literatura que o volume inicial dos cistos tiroidianos, bem como o volume e a característica do líquido aspirado, poderiam influenciar na efetividade da aspiração simples ou da aspiração seguida pela escleroterapia. Cistos com diâmetro maior que 4cm ou aspirados hemorrágicos apresentariam maior probabilidade de recorrência (9,10). Os 5 pacientes de nossa casuística (29%), que apresentaram recorrência parcial do cisto durante o tratamento, tinham conteúdo hemorrágico ou sero-hemorrágico em todas as aspirações. Monzani e cols. (30), ao tratarem 20 pacientes com cistos tiroidianos utilizando a IPE, verificaram recorrência no primeiro mês após etanol em 5 casos, sendo que, em 4 deles, o líquido era hemorrágico. Todavia, Antonelli e cols. (11) não encontraram correlação entre a característica do fluido aspirado ou o tamanho inicial dos cistos com a recorrência, atribuindo seus bons resultados, no caso do cisto hemorrágico, à lesão induzida pelo etanol na camada íntima vascular, o que causaria trombose e obliteração dos pequenos vasos intranodulares.
Dos nossos 5 pacientes com recorrência parcial do cisto, 4 apresentavam volume inicial maior que a mediana do grupo (10,9mL). Yasuda e cols. (9) também obtiveram menor efetividade da IPE em cistos de grande volume, acima de 10mL. Zingrillo e cols. (12) encontraram redução nodular maior que 50% em relação ao volume inicial em 40 dos 43 pacientes tratados (93%); os 3 pacientes não responsivos à IPE apresentavam cistos maiores que 50mL.
A mediana de 4 injeções utilizadas nos nossos pacientes com nódulos císticos é maior que de outros trabalhos da literatura, que utilizaram 1 a 2 injeções para tratamento de cistos puros (9,11,30). Este fato deve-se ao número maior de cistos com componente sólido em nossa casuística, o que nos obrigou a um número maior de sessões para a redução do componente sólido dos mesmos. Contudo, a inclusão dos nódulos mistos não interferiu na percentagem de redução final dos nódulos (92%), quando comparada a outras séries que obtiveram redução entre 72 e 95% (9,11,12,30).
Entre nossos pacientes com nódulos autônomos, os 4 com NT evoluíram para eutiroidismo clínico 20 dias após o início da IPE. Os dois com NA permaneceram em eutiroidismo clínico durante todo o período de seguimento. Laboratorialmente, ocorreu normalização da função tiroidiana em todos os pacientes, 1 a 3 meses depois da IPE. Essa evolução demonstra que a IPE é uma forma rápida de resolução da tirotoxicose, embora alguns pacientes necessitem de tempo mais prolongado para a normalização de todos os parâmetros laboratoriais. A razão de dois pacientes terem apresentado transitoriamente valores discretamente diminuídos de T4L durante a evolução pode ser explicada pela lenta normalização da secreção hipofisária do TSH após supressão prolongada (31). Corrobora esta hipótese a observação de que neles, apesar da concentração subnormal de T4L, os valores de TSH não estavam elevados.
Um paciente evoluiu com hipotiroidismo subclínico, com normalização do TSH nas avaliações subseqüentes após o primeiro ano (dados não apresentados neste trabalho). Essa condição pode ser explicada pela recuperação mais lenta do tecido tiroidiano extranodular após um período prolongado de supressão. Na literatura, a evolução para hipotiroidismo pode ocorrer em 0,3% dos casos, com maior probabilidade naqueles pacientes que apresentam anticorpos antitiroidianos antes da IPE (5,7,32,33).
Não houve recorrência de tirotoxicose durante o período de observação, resultado que está de acordo com as séries publicadas com seguimento de até 5 anos (5,7,32,33).
No estudo multicêntrico apresentado por Lippi e cols. (6), que analisaram 429 pacientes com NA tratados com IPE, verificou-se melhor resultado funcional em pacientes com volume nodular inicial menor ou igual a 15mL, porém houve redução nodular em todos os casos, independente da resposta funcional. Recentemente, Tarantino e cols. (29) indicaram a IPE como uma forma eficaz e segura de tratamento para NA maiores que 30mL, injetando 5 a 14mL de etanol por procedimento, considerando que a possível falha no tratamento dos NA de grande volume seja devida à pequena quantidade de etanol utilizada por sessão.
Quatro de nossos pacientes com NA apresentavam nódulos menores que 15mL, todos tiveram normalização dos níveis de TSH e T4L e em 3 deles houve reativação do tecido extranodular. Utilizamos 5 a 8mL de etanol por sessão para tratamento dos 2 nódulos com volume inicial maior que 40mL e ambos evoluíram para eutiroidismo.
Se, além da compensação hormonal, o objetivo do tratamento for a redução da massa nodular visando reduzir compressão, consideramos que a IPE proporcionou esse resultado pois, além da normalização laboratorial, observou-se redução de 66% do volume (variação: 62 a 89%). Essa redução é superior à relatada na literatura após doses terapêuticas de 131I (35% em 3 meses e 45% após 2 anos), sugerindo que a IPE pode representar uma alternativa ao tratamento com 131I para NA volumosos em pacientes com contra-indicação ou que recusem cirurgia (7,34,35).
A dor foi o principal efeito colateral referido pelos nossos pacientes, especialmente nas duas primeiras sessões. Aqueles com cistos tiroidianos apresentaram dor que os pacientes com nódulos autônomos e sólidos não apresentaram. A distensão da cápsula nodular durante o procedimento pode explicar, em parte, a maior freqüência e intensidade da dor nestes pacientes. A dor pode ser minimizada utilizando-se pequeno volume de etanol em cada sessão, com injeção lenta e manutenção da agulha no local da punção por 1 a 2 minutos, o que impede o refluxo do etanol pelo trajeto da agulha.
Nas 294 sessões realizadas, ocorreram 5 casos (1,7%) de disfonia transitória com resolução em todos, que variou de 30 minutos até uma semana. A literatura não cita nenhum caso de lesão permanente do nervo laríngeo recorrente, sendo que a disfonia transitória é relatada em 3,9% dos pacientes e pode permanecer por semanas até 3 meses (6,7,20). Para prevenir a ocorrência da disfonia e dos outros efeitos colaterais, deve-se evitar o escape do etanol para o tecido extranodular, que pode ser monitorizado pelo US durante a injeção.
Consideramos que nosso trabalho confirmou, em nosso meio, que a IPE é uma forma de obtenção relativamente rápida do eutiroidismo em pacientes com nódulos autônomos tóxicos, com baixa incidência de hipotiroidismo e de recidivas, sendo uma alternativa ao tratamento cirúrgico ou com iodo radioativo. Além disso, no tratamento de cistos tiroidianos, a IPE representa uma alternativa eficaz, pois apresenta baixo índice de recidivas e efeitos colaterais mínimos. Finalmente, a redução significativa do volume nodular, a não-evolução para o hipotiroidismo e a ausência de cicatriz, tornam a IPE uma boa opção terapêutica para nódulos os tiroidianos sólidos.
Recebido em 28/11/02
Revisado em 23/04/03 e 15/08/03
Aceito em 22/08/03
- 1. Solbiati L, Giangrande A, De Pra L, Bellotti E, Cantu P, Rovetto C. Percutaneous ethanol injection of parathyroid tumors under US guidance: treatment for secondary hyperparathyroidism. Radiology 1985;155:607-10.
- 2. Livraghi T, Festi D, Monti F, Salmi A, Vettori C. US-guided percutaneous alcohol injection of small hepatic and abdominal tumors. Radiology 1986;161:309-12.
- 3. Charboneau JW, Hay ID, Van Heerden JA. Persistent primary hyperparathyroidism: successful ultrasound-guided percutaneous ethanol ablation of an occult adenoma. Mayo Clin Proc 1988;63:913-7.
- 4. Livraghi T, Paracchi A, Ferrari C, Bergonzi M, Garavaglia G, Raineri P, et al. Treatment of autonomous thyroid nodules with percutaneous ethanol injection: preliminary results. Radiology 1990;75:827-9.
- 5. Livraghi T, Paracchi A, Ferrari C, Reschini E, Macchi RM, Bonifacino A. Treatment of autonomous thyroid nodules with percutaneous ethanol injection: 4 year experience. Radiology 1994;190:529-33.
- 6. Lippi F, Ferrari C, Manetti L, Rago T, Santini F, Monzani F, et al. Treatment of solitary autonomous thyroid nodules by percutaneous ethanol injection: results of an Italian multicenter study. J Clin Endocrinol Metab 1996;81:3261-4.
- 7. Ferrari C, Reschini E, Paracchi A. Treatment of the autonomous thyroid nodule: a review. Eur J Endocrinol 1996;135:383-90.
- 8. Hermus AR, Huysmans DA. Treatment of benign nodular thyroid disease. N Engl J Med 1998;338:1438-47.
- 9. Yasuda K, Osaki O, Sugino K, Yamashita T, Toshima K, Ito K, et al. Treatment of cystic lesions of the thyroid by ethanol instillation. World J Surg 1992;16:958-61.
- 10. Verde G, Papini E, Pacella CM, Gallotti C, Delpiano S, Strada S, et al. Ultrasound guided percutaneous ethanol injection in the treatment of cystic thyroid nodules. Clin Endocrinol 1994;41:719-24.
- 11. Antonelli A, Campatelli A, Di Vito A, Alberti B, Baldi V, Salvioni G, et al. Comparison between ethanol sclerotherapy and emptying with injection of saline in treatment of thyroid cysts. Clin Investig 1994;72:971-4.
- 12. Zingrillo M, Torlontano M, Chiarella R, Ghiggi MR, Nirchio V, Bisceglia M, et al. Percutaneous ethanol injection may be a definitive treatment for symptomatic thyroid cystic nodules not treatable by surgery: five-year follow-up study. Thyroid 1999;9:763-7.
- 13. Goletti O, Monzani F, Lenziardi M, Lippolis PV, De Negri F, Caraccio N, et al. Cold thyroid nodules: a new application of percutaneous ethanol injection treatment. J Clin Ultrasound 1994;22:175-8.
- 14. Caraccio N, Goletti O, Lippolis PV, Casolaro A, Cavina E, Miccoli P, et al. Is percutaneous ethanol injection a useful alternative for the treatment of the cold benign thyroid nodule? Five years experience. Thyroid 1997;7:699-704.
- 15. Zingrillo M, Collura D, Ghiggi MR, Nirchio V, Trischitta V. Treatment of large cold benign thyroid nodules not eligible for surgery with percutaneous ethanol injection. J Clin Endocrinol Metab 1998;83:3905-7.
- 16. Bennedbaek FN, Hegedus L. Percutaneous ethanol injection therapy in benign solitary solid cold thyroid nodules: a randomized trial comparing one injection with three injections. Thyroid 1999;9:225-34.
- 17 Martino E, Murtas ML, Loviselli A, Piga M, Petrini L, Miccoli P, et al. Percutaneous intranodular ethanol injection for treatment of autonomously functioning thyroid nodules. Surgery 1992;112:1161-4.
- 18. Crescenzi A, Papini E, Pacella CM, Rinaldi R, Panunzi C, Petrucci L, et al. Morphological changes in a hyperfunctioning thyroid adenoma after percutaneous ethanol injection: histological, enzymatic and sub-microscopical alterations. J Endocrinol Invest 1996;19:371-6.
- 19. Braga M. Tratamento de nódulos autônomos e císticos da tireóide com injeção percutânea de etanol. Curitiba: 1998, 58p. [Dissertação de mestrado. Curso de Pós-Graduação em Medicina Interna, Universidade Federal do Paraná].
- 20. Schumm-Draeger PM. Ultrasound-guided percutaneous ethanol injection in the treatment of autonomous thyroid nodules a review. Exp Clin Endocrinol Diabetes 1998;106:S59-S62.
- 21. Cerbone G, Spiezia S, Colao A, Marzullo P, Assanti AP, Lucci R, et al. Percutaneous ethanol injection under Power Doppler ultrasound assistance in the treatment of autonomously functioning thyroid nodules. J Endocrinol Invest 1999;22:7529.
- 22. Di Lelio A, Rivolta M, Casati M, Capra M. Treatment of autonomous thyroid nodules: value of percutaneous ethanol injection. Am J Roentgenol 1995;164:207-13.
- 23. Ishizaka H, Ishijima H, Katsuya T, Koyama Y. Percutaneous ethanol injection therapy: use of a directable needle guide. Am J Roentgenol 1997;168:1563-4.
- 24. Tarantino L, Giorgio A, Mariniello N, de Stefano G, Perrota A, Aloisio V, et al. Percutaneous ethanol injection of large autonomous hyperfunctioning thyroid nodules. Radiology 2000;214:143-8.
- 25. Maciel RMB. Câncer da tiróide. In: Tratado de endocrinologia. BL Wajchenberg, editor. São Paulo: Roca, 1992 p.404-27.
- 26. Ward LS, Carneiro MCO, Toledo AJO, Maciel RMB. A citologia do material obtido por punção aspirativa da tiróide como método único indicativo de cirurgia: análise de custo-benefício. Arq Bras Endocrinol Metab 1993;37:18-22.
- 27. Blum M, Yee J. Advances in thyroid imaging: Thyroid sonography: when and how should it be used? Thyroid Today 1997;20:1-13.
- 28. Knudsen N, Bols B, Bulow I, Jorgensen T, Perrild H, Ovesen L, et al. Validation of ultrasonography of the thyroid gland for epidemiological purposes. Thyroid 1999;9:106984.
- 29. Vieira JGH, Kunii IS, Nishida SK, Matsumura LK, Russo EMK, Maciel RMB. Desenvolvimento de um método imunofluorimétrico para a dosagem de tirotrofina humana (TSH) no soro e em sangue total colhido em papel de filtro. Arq Bras Endocrinol Metab 1992;36:7-12.
- 30. Vitti P, Martino E, Aghini-Lombardi F, Rago T, Antonangeli L, Maccherini A, et al. Thyroid volume measurement by ultrasound in children as a tool for the assessment of mild iodine deficiency. J Clin Endocrinol Metab 1994;79:6003.
- 31. Monzani F, Lippi F, Goletti O, Del Guerra P, Caraccio N, Lippolis PV, et al. Percutaneous aspiration and ethanol sclerotherapy for thyroid cysts. J Clin Endocrinol Metab 1994;78:8002.
- 32. Paracchi A, Ferrari C, Livraghi T, Reschini E, Macchi RM, Bergonzi M, et al. Percutaneous intranodular ethanol injection: a new treatment for autonomous thyroid adenoma. J Endocrinol Invest 1992;15:353-62.
- 33. Monzani F, Caraccio N, Goletti O, Lippolis PV, Casolaro A, Del Guerra P, et al. Five-year follow-up of percutaneous ethanol injection for the treatment of hyperfunctioning thyroid nodules: a study of 117 patients. Clin Endocrinol 1997;46:9-15.
- 34. Messina G, Viceconti N, Trinti B. Diagnostic items and treatment of Plummers disease: a study on 180 patients. Clin Ter 1998;149:191-5.
- 35. Goletti O, Monzani F, Caraccio N, Del Guerra P, Lippolis PV, Pucciarelli M, et al. Percutaneous ethanol injection treatment of autonomously functioning single thyroid nodules: optimization of treatment and short term outcome. World J Surg 1992;16:784-90.
- 36. Nygaard B, Hegedüs L, Nielsen KG, Ulriksen P, Hansen JM. Long-term effect of radioactive iodine on thyroid function and size in patients with solitary autonomously functioning toxic thyroid nodules. Clin Endocrinol 1999;50:197-202.
Datas de Publicação
-
Publicação nesta coleção
21 Jan 2004 -
Data do Fascículo
Out 2003
Histórico
-
Recebido
28 Nov 2002 -
Revisado
15 Ago 2003 -
Aceito
22 Ago 2003