1. 引言
兰科植物种类繁多,主要分布在热带和亚热带地区,少数分布于温带地区,许多种类具有极高的观赏价值、重要的药用价值和较高的经济价值 [1]。近年来,由于全球气候变化、环境破坏及人类过多采挖等诸多原因,野生兰科植物资源遭到严重的破坏,珍稀兰科植物资源保护引起了许多国家和国际组织的高度关注 [2] [3]。
国外学者认为,要有针对性的保护野生兰科植物,必须对其资源保护现状进行评估,弄清其受威胁的主要原因。研究发现,兰科植物数量的减少,主要是由于森林采伐、土地利用方式改变、过度采集及生境破坏造成的。研究者认为,为了及时掌握野生兰科植物资源数量的动态变化,应对野生兰科植物进行长期的监测,运用标本材料和生物居群统计等方法进行兰科植物濒危状况评估。基于生活史阶段模型对兰科植物的种群动态进行研究,可以得知种群正处于哪个阶段,再结合转移矩阵模型计算出种群各个阶段的转移概率,同时采用弹性分析方法或干扰分析的方法,确定种群一些参数的变化是否会对种群的增长率产生影响以及产生的影响有多大 [4] [5],可以据此了解什么生活史阶段对种群的增长率影响最大 [6],因此,可以在特定阶段密切关注兰科植物的长势等情况,争取使其种群增长率达到较大范围,从而达到保护兰科植物的目的。
为了保护珍稀野生兰科植物,我国采取了一系列相关措施,建立了国家级的兰科植物自然保护区(如广西雅长兰科植物国家级自然保护区),对兰科植物的物种数量、居群分布、物种多样性、生境、保护现状、种质资源保护、组培快繁等方面进行大量研究,取得了不少的科研成果。
李鹏等 [7] 对黄龙沟内兰科植物种类、生境、居群及繁殖进行了调查,分析兰科植物的生物学特性及多样性的形成,深入探讨黄龙沟兰科植物的保护问题。李南岍等 [8] 对北京松山国家级自然保护区兰科植物的生物多样性及保护状况进行了研究,并提出了一些有价值的意见和建议。
王代谷等 [9] 对贵州省兜兰属植物进行组织培养和快繁技术研究时发现,兜兰属杂交种的组培相对容易,原生种则比较困难,我国现有的栽培种几乎都是从国外引进的杂交种,组培技术目前还未能实现商业上规模化生产,因此,在较长时期内,我国兜兰属植物的保护应以原地保护为主,积极开展珍稀物种的保护生物学基础研究,减少对兰科植物原生环境的破坏,大力发展和完善迁地保护技术体系。
虽然兰科植物资源不断减少,一些珍稀种类处于濒临灭绝状态,但广西建立了十多个国家级自然保护区,兰科植物资源保护相对完好,科研工作也持续有效展开 [10] [11]。
冯昌林、陈新军、黄承标等 [12] [13] [14] 对广西雅长林区兰科植物的生境条件、种质资源保护等问题进行了调查研究,并针对该林区兰科植物保护的问题,提出了一些对策和建议。
谭卫宁等人 [15] 对木论自然保护区兜兰属植物进行调查研究时发现,该保护区的野生兜兰大部分为半附生类型。其中,硬叶兜兰(Paphiopedilum micranthum)数量最多且分布较广,每个居群都至少有5丛,主要生长在腐殖质较厚的石缝、山顶及其附近位置。据初步统计,该保护区的白花兜兰(P. emersonii)分布在7个不同区域,约有208丛;小叶兜兰(P. barbigerum)大约有60丛;带叶兜兰(P. hirsutissimum)有100丛。小叶兜兰、白花兜兰和带叶兜兰的生境相似,主要分布在山腰以上的石壁上;麻栗坡兜兰(P. malipoense)有4小片,共有160多株,主要生长在林下腐殖质丰富、较湿润的石缝土壤中。
谢代祖等 [16] 在木论自然保护区调查发现,麻栗坡兜兰分布点的植物群落分层明显(可分为乔木层、灌木层和草本层),但乔木层的亚层结构不明显(可分为2个亚层),其上层主要植物种类有檵木、假桂皮等,其下层植物种类和数量较多,优势种主要是檵木,其次是米碎叶和假苹婆,常见物种还有鱼骨木、细叶楷木等。
覃文渊等 [17] 对木论自然保护区白花兜兰分布点的植物群落结构特征进行了调查研究,结果发现:白花兜兰分布点的植物群落结构也分为3层,与麻栗坡兜兰植物群落结构相似,乔木层的亚层也不明显,其优势种为圆果化香,亚优种为檵木,植物种类主要有圆果化香、檵木、腺叶野樱等;灌木层主要植物有腺叶野樱、山黄皮等;草本层主要植物有白花兜兰、小叶兜兰、广西鸢尾兰等,小叶兜兰和广西鸢尾兰为白花兜兰分布点的主要伴生种。
广西木论国家级自然保护区位于桂西北典型喀斯特地区,岩溶高度发育,生境复杂,物种资源丰富,已知兰科植物有120多种,其中兜兰属植物有5种 [15]。虽然人们对兰科植物进行了大量的研究,但对桂西北岩溶地区野生兜兰的研究还有待深入。本研究用常规的生态学调查方法,对保护区内的兜兰分布点进行调查研究,将传统的土壤理化分析与分子微生物技术手段有机结合,在深入调查了解生境特点的基础上,力求找到保护野生兜兰的方法,以期为兜兰属植物的引种栽培和生物学保育提供参考,为野生兜兰种群的扩大及珍稀物种迁地保护提供理论依据。
2. 材料与方法
2.1. 调查区域气候地理概况
广西木论国家级自然保护区位于环江毛南族自治县西北部,属于典型的喀斯特地形地貌,地理坐标为107˚53'29''~108˚05'45''E,25˚06'09''~25˚12'25''N,总面积约10,829.7 hm2,为亚热带季风气候区,年平均气温15.0℃~18.7℃,极端高温36℃,极端低温−5℃,无霜期235~290 d,年均降雨1638 mm,森林覆盖率达95%以上,³10℃的有效积温为4700℃~6300℃,可能蒸散量(Ep)年总量为874 mm [18]。
2.2. 样品采集及处理
2.2.1. 供试样品
本研究的样品为木论自然保护区野生兜兰的根际土壤。根据岩溶地区环境的特点,以及野生兜兰的分布情况,2016年4月中旬至5月上旬,按蛇形采样方法,在木论自然保护区的兰花山、明利、当河山、下寨、瞭望塔、中论等野生兜兰主要分布点,分别采集麻栗坡兜兰、小叶兜兰、白花兜兰、硬叶兜兰、带叶兜兰0~10 cm深度的根际土,五种野生兜兰的代号分别用MPL、XY、BH、YY、DY表示。用于微生物研究的土壤样品,采集后立即放入冰盒中低温保存,尽快带回实验室中低温保存备用;用于土壤理化分析的土壤样品,先过2 mm标准筛,然后用四分法取适量放入封口袋中保存,尽快带回实验室进行风干处理。在土壤样品采集过程中,要记录采样点的地理坐标、海拔高度、植被分布等相关情况。采样点的分布情况见图1。

Figure 1. Distribution of sampling points of wild Paphiopedilum rhizosphere soil in Mulun nature reserve
图1. 木论自然保护区野生兜兰根际土采样点分布
2.2.2. 试剂和仪器
本研究使用的主要药品和试剂见表1。

Table 1. List of experimental drugs and reagents
表1. 实验药品和试剂一览表
本研究所用实验仪器见表2。

Table 2. List of experimental instruments
表2. 实验仪器一览表
2.3. 实验方法
2.3.1. 野生兜兰种群数量、分布及植物群落结构调查
木论自然保护区野生兜兰种群数量、分布及兜兰分布点植物群落结构调查,采用常规的生态学野外调查方法。分别在多个不同季节进行野外调研,观察野生兜兰的数量、分布及相关情况,并做好相应的记录;调查植物群落结构时,要观察群落分层情况,并记录植物群落的优势种、建群种、伴生种等相关信息和数据。
2.3.2. 土壤微生物总DNA的提取和测序
将野外采集的土样带回实验室后,立即置4℃冰箱中保存备用,在48 h内进行提取土壤微生物总DNA的实验,所用方法为土壤基因组试剂盒提取法。按照实验步骤和操作说明提取出土壤微生物总DNA后,将其置于−20℃的冰箱中保存,每个土样做三个重复,其余的土样置于−86℃超低温保存。将土壤微生物总DNA用0.7%的琼脂糖凝胶进行电泳,染色后,在紫外凝胶成像仪下观察,拍下电泳图,条带清晰浓度高的DNA样品,即可送去有资质且比较权威的国内测序公司进行高通量测序(若DNA浓度不太高,则要进行PCR扩增,扩大DNA的浓度后,再进行凝胶电泳,看条带清晰与否),测序的土壤微生物类群,主要包括细菌和真菌。
2.3.3. 土壤理化分析
将野外采集的土壤样品自然风干,用木棒或其他工具粉碎,分别过20、60、100目标准筛,分别保存于不同型号的聚乙烯塑料封口袋中,做好标记。土壤含水量测定用重量法,土壤有机质含量测定用重铬酸钾–浓硫酸氧化比色法 [19] [20] [21],土壤全氮含量测定用凯氏法 [22] [23] [24],土壤碱解氮含量测定用碱解扩散法 [25] [26],土壤全磷含量测定用氢氧化钠碱熔–钼蓝比色法 [27] [28] [29],土壤速效磷含量测定用碳酸氢钠浸提–钼锑抗比色法 [30] [31],土壤全钾含量测定用氢氧化钠碱熔–火焰光度计法 [32] [33],土壤速效钾含量测定用乙酸铵浸提–火焰光度计法 [34] [35] [36],土壤pH测定用电位法 [37]。
2.3.4. 数据处理
实验数据处理用Excel 2010进行,每个样品的测定均做3个重复,结果取平均值;一维方差分析(One-way ANOVE)和Spearman相关性分析,用数理统计软件SPSS 20.0进行,采样图的绘制用专业工具软件Arc GIS Pro进行。
3. 结果与分析
3.1. 野生兜兰种群数量、分布及植物群落结构
麻栗坡兜兰主要分布在林下腐殖质丰富、湿度相对较大的土壤中,数量较多;小叶兜兰、白花兜兰、带叶兜兰的生境相近,均分布在岩石裸露、土层浅薄的石缝或石壁上;硬叶兜兰数量最多,一般生长在腐殖质丰富的石缝;小叶兜兰和带叶兜兰分布点生长的兰科植物也是比较耐旱的种类,如石斛属、石豆兰属等;硬叶兜兰主要伴生植物有石仙桃属、钗子股属等极耐早的种类;白花兜兰和麻栗坡兜兰分布点植物群落的分层比较明显,主要分为乔木、灌木和草本3层。
3.2. 不同野生兜兰根际土壤微生物多样性比较
野生兜兰根际土壤细菌和真菌的多样性主要是用高通量测序技术测定细菌和真菌的16srDNA,测序结果见图2~19。

Figure 2. Bacterial dilution curves of five wild Paphiopedilum rhizosphere soils
图2. 五种野生兜兰根际土的细菌稀释曲线

Figure 3. Analysis of heatmap bacteria in rhizosphere soil of five wild Paphiopedilum species
图3. 五种野生兜兰根际土中的热图细菌分析

Figure 4. Bacterial phylum level classification map in rhizosphere soil of five wild Paphiopedilum species
图4. 五种野生兜兰根际土中的细菌门水平分类图

Figure 5. Bacterial phylum level classification map in the rhizosphere soil of P. emersonii
图5. 白花兜兰根际土中的细菌门水平分类图

Figure 6. Bacterial phylum level classification map in the rhizosphere soil of P. hirsutissimum
图6. 帯叶兜兰根际土中的细菌门水平分类图

Figure 7. Bacterial phylum level classification map in the rhizosphere soil of P. malipoense
图7. 麻栗坡兜兰根际土中的细菌门水平分类图
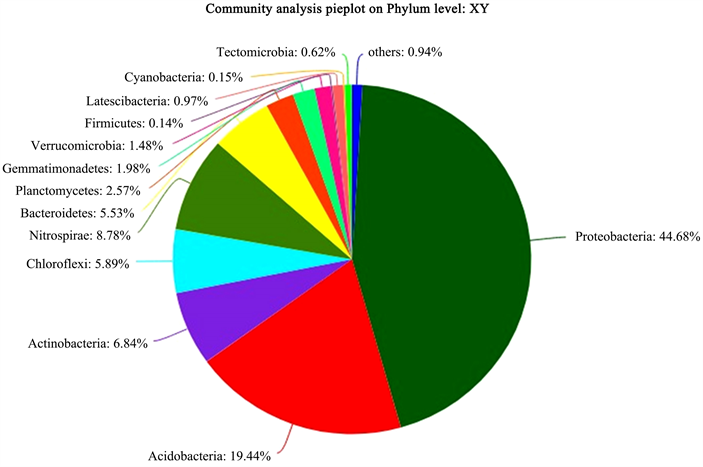
Figure 8. Bacterial phylum level classification map in the rhizosphere soil of P. barbigerum
图8. 小叶兜兰根际土中的细菌门水平分类图

Figure 9. Bacterial phylum level classification map in the rhizosphere soil of P. micranthum
图9. 硬叶兜兰根际土中的细菌门水平分类图
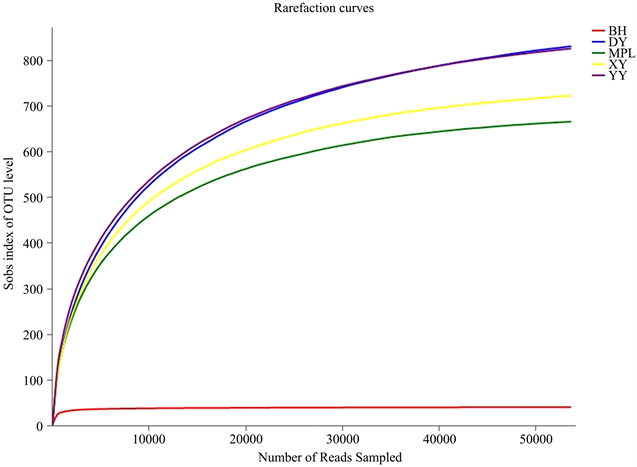
Figure 10. Fungal dilution curves of five wild Paphiopedilum rhizosphere soils
图10. 五种野生兜兰根际土的真菌稀释曲线

Figure 11. Analysis of heatmap fungi in the rhizosphere soil of five wild Paphiopedilum species
图11. 五种野生兜兰根际土中的热图真菌分析
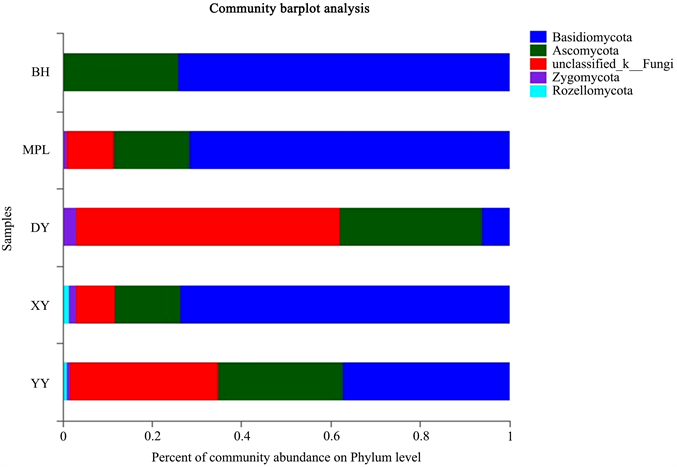
Figure 12. Fungal phylum level classification map in the rhizosphere soil of five wild Paphiopedilum species
图12. 五种野生兜兰根际土中的真菌门水平分类图
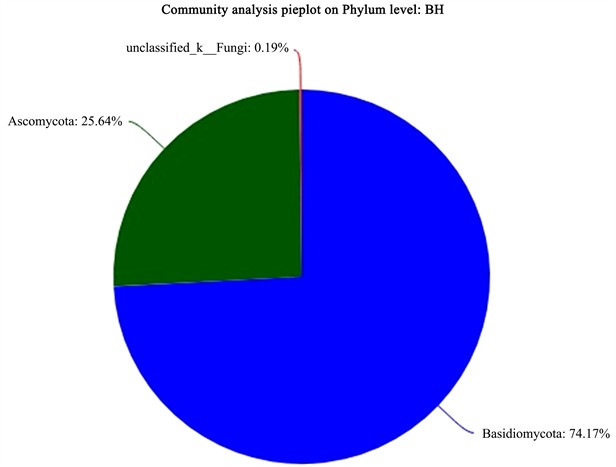
Figure 13. Fungal phylum level classification map in the rhizosphere soil of P. emersonii
图13. 白花兜兰根际土中的真菌门水平分类图

Figure 14. Fungal phylum level classification map in the rhizosphere soil of P. hirsutissimum
图14. 带叶兜兰根际土中的真菌门水平分类图
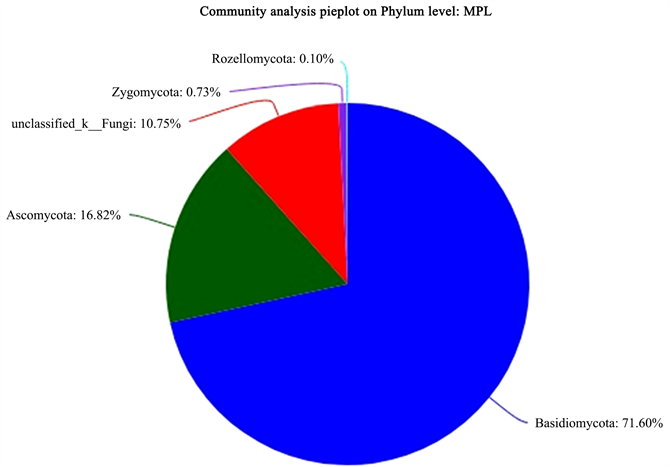
Figure 15. Fungal phylum level classification map in the rhizosphere soil of P. malipoense
图15. 麻栗坡兜兰根际土中的真菌门水平分类图
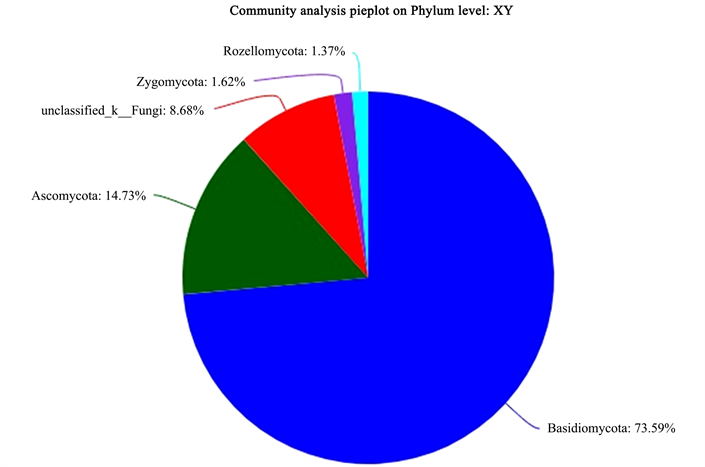
Figure 16. Fungal phylum level classification map in the rhizosphere soil of P. barbigerum
图16. 小叶兜兰根际土中的真菌门水平分类图

Figure 17. Fungal phylum level classification map in the rhizosphere soil of P. micranthum
图17. 硬叶兜兰根际土中的真菌门水平分类图
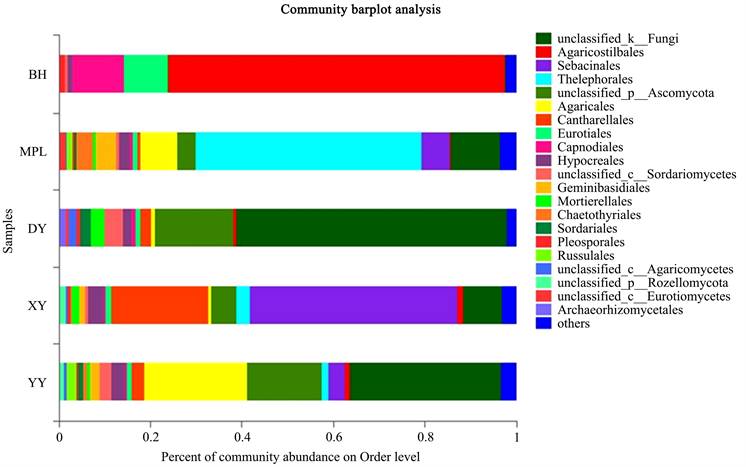
Figure 18. The order level classification map of fungi in the rhizosphere soil of five wild Paphiopedilum species
图18. 五种野生兜兰根际土中的真菌目水平分类图

Figure 19. The genus level classification map of fungi in the rhizosphere soil of five wild Paphiopedilum species
图19. 五种野生兜兰根际土中的真菌属水平分类图
图2为5种不同野生兜兰根际土壤的细菌稀释曲线,从图中可见,曲线趋向平坦,说明测序数据量合理,可以反映样本中绝大多数微生物多样性信息。图3为5种不同野生兜兰根际土壤热图细菌分析图,颜色深浅表示丰度不同,颜色偏暖代表物种多样性和丰度越大,从图中可看出样本聚类主要分4大类,其中白花兜兰样本物种多样性和丰度与其他4个样本有较为明显的差异。图4为5种不同野生兜兰根际土中的细菌门水平分类图,从中可看出,五种兜兰根际土壤中的细菌主要由放线菌门、酸杆菌门、变形菌门、Nitrospirae、ChIoroflexi和Bacteroidetes构成,丰度各有不同。图5~9分别是五种野生兜兰根际土细菌门水平组成饼图,其中白花兜兰主要包括放线菌门、变形菌门、绿弯菌门和酸杆菌门组成,其中放线菌门占比34.97%,变形菌门占比29.12%,绿弯菌门占比14.00%,酸杆菌门占比7.40%;小叶兜兰、麻栗坡兜兰和硬叶兜兰中变形菌门占比较高,约占50%,其次是酸杆菌门;带叶兜兰中变形菌门和酸杆菌门分别占比35.03%和32.99%,其次是Nitrospirae、绿弯菌门、Bacteroidetes和放线菌门。
图10为5种不同野生兜兰根际土的真菌稀释曲线,从图中可见曲线趋向平坦,说明测序数据量合理,可以反映样本中绝大多数的微生物多样性信息。图11为5种不同野生兜兰根际土热图真菌分析图,颜色深浅表示丰度不同,从图中可看出YY和DY聚为一类,说明两者真菌菌群相似度较高;MPL和XY聚为一类,再与BH聚为一大类。图12、图18和图19分别为5种不同野生兜兰根际土壤中真菌的门水平、目水平、属水平分类图。从门水平组成可看出,5种野生兜兰根际土壤中的真菌主要由担子菌门、子囊菌门和未知真菌构成,丰度各有不同。图13~17分别是5种野生兜兰根际土真菌门水平组成饼图,5种野生兜兰主要有担子菌门和子囊菌门组成,但在每种兜兰的占比不同:白花兜兰、麻栗坡兜兰、小叶兜兰和硬叶兜兰中担子菌门占比较高,其次为子囊菌门和未分类真菌,但是带叶兜兰样本却相反,其担子菌门占比6.01%,子囊菌门占比31.94%,未分类真菌占59.14%;在目水平,与其他样本中不同的是,BH样本的Agaricostibales丰度最高,多样性相对较低,MPL中Thelephorales丰度最高,DY中为未知的Ascomycota丰度最高,XY中丰度大小依次是Sebacinates、Cantharellales、unclassified_k_Fungi;YY中主要以unclassified_k_Fungi为主。在属水平,BH中以Sterigmatomyces为主,XY以Sebacina为主,MPL以未分类的Thelephoraceae为主,DY和YY主要是未知真菌丰度较高。
从图中可以看出,5种不同野生兜兰根际土壤中的细菌在门水平主要包括放线菌门、酸杆菌门和变形菌门,真菌在门水平中主要包括担子菌门和子囊菌门,其中真菌在目水平和属水平中多样性较高,这说明5种野生兜兰的生境存在一定的差异,野生兜兰对生存环境的要求较高。其中真菌在目水平和属水平上种类丰富,也可能与兰科植物与真菌共生有关。
3.3. 野生兜兰根际土壤微生物门水平相关性分析
3.3.1. 细菌门水平相关性分析
由表3可知,变形菌门显著影响硝化螺旋菌门,即变形菌门占比越小硝化螺旋菌门占比越多;酸杆菌门与拟杆菌门显著相关(p < 0.01),放线菌门与绿弯菌门有极显著的负相关。
3.3.2. 真菌门水平相关性分析
由表4可知,担子菌门与子囊菌门有极显著的负相关,即担子菌门占比越高子囊菌门占比也越低。
3.4. 不同野生兜兰根际土理化特性比较
木论自然保护区野生兜兰根际土壤主要理化指标的测定结果见表5,其鲜土水分含量为14.87%~45.37% (风干土水分含量为2.94%~15.21%),pH为6.49~8.39,有机质含量为20.76 g/kg~31.37 g/kg,全氮含量为2.36 g/kg~19.34 g/kg,碱解氮含量为0.26 g/kg~1.14 g/kg,全磷含量为0.29 g/kg~1.29 g/kg,速效磷含量为2.09 mg/kg~42.38 mg/kg,全钾含量在4.02 g/kg~12.13 g/kg,速效钾含量为69.1 mg/kg~426.3 mg/kg。与国内其他相邻的自然保护区相比,土壤有机质含量属于中等偏低水平,土壤全氮和全磷含量居中上水平,土壤全钾含量则明显偏低 [38]。大部分野生兜兰分布点之间,其土壤理化性质均有明显的差异。

Table 3. Correlation analysis of rhizospheric soil bacteriophyta levels in Paphiopedilum distribution points
表3. 兜兰分布点根际土壤细菌门水平相关性分析
**相关性在0.01级别显著(双尾)。

Table 4. Correlation analysis of rhizospheric soil fungal phylum levels in Paphiopedilum distribution points
表4. 兜兰分布点根际土壤真菌门水平相关性分析
**相关性在0.01级别显著(双尾)。


Table 5. Comparison of physicochemical characteristics of rhizosphere soil of different species of wild Paphiopedilum in Mulun nature reserve
表5. 木论自然保护区不同种类野生兜兰根际土壤理化特性比较
注:同一列数据中不同小写字母表示差异显著(p < 0.05),同一列数据中不同大写字母表示差异极为显著(p < 0.01)。
3.5. 野生兜兰根际土理化特性相关性分析
表6的相关性分析结果表明,鲜土含水量与pH呈正相关但不显著;土壤全氮与土壤有机质、碱解氮含量有极显著正相关,由图20可知,土壤全氮与有机质呈线性正相关;从图21也可明显看出,野生兜兰根际土壤全氮与碱解氮含量呈线性正相关;速效磷与全磷相关性不显著;速效钾与全钾显著相关(p < 0.01);野生兜兰根际土壤有机质含量显著影响土壤全磷、速效磷,从图22可以看出,兜兰根际土壤全磷和有机质含量呈线性正相关;碱解氮和全磷呈极显著的正相关(p < 0.01);速效钾与其他土壤理化指标在置信度(双侧)为0.01时,相关性显著,从图23可看出,野生兜兰根际土壤速效磷与速效钾含量呈线性正相关。

Table 6. Correlation analysis of physical and chemical properties of wild Paphiopedilum rhizosphere soil at different distribution points
表6. 不同兜兰分布点野生兜兰根际土壤理化性质相关性分析
*相关性在0.05级别显著(双尾);**相关性在0.01级别显著(双尾)。

Figure 20. Correlation between total nitrogen and organic matter content in rhizosphere soil of wild Paphiopedilum
图20. 野生兜兰根际土壤全氮与有机质含量的相关性

Figure 21. Correlation between total nitrogen and alkali hydrolyzed nitrogen content in rhizosphere soil of wild Paphiopedilum
图21. 野生兜兰根际土壤全氮与碱解氮含量的相关性

Figure 22. Correlation between organic matter and total phosphorus content in rhizosphere soil of wild Paphiopedilum
图22. 野生兜兰根际土壤有机质与全磷含量的相关性
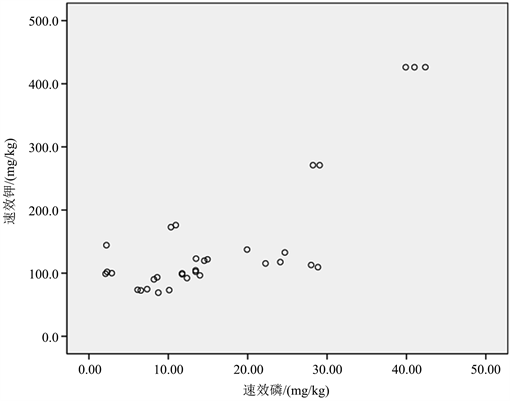
Figure 23. Correlation between available potassium and available phosphorus content in rhizosphere soil of wild Paphiopedilum
图23. 野生兜兰根际土壤速效钾与速效磷含量的相关性
3.6. 野生兜兰根际土壤微生物与土壤理化特性的相关性
由表7可知,兜兰根际土壤全磷、速效钾含量显著影响根际土壤担子菌门、子囊菌门、变形菌门和硝化螺旋菌门生物量;拟杆菌门与土壤速效磷含量显著相关(p < 0.01);放线菌门、绿弯菌门和根际土壤pH、有机质、全氮及全钾含量均有显著的相关性。

4. 讨论
4.1. 野生兜兰的生境及根际土壤理化特性有较大差异
对木论自然保护区野生兜兰调查发现,该保护区野生兜兰的种类和居群数量都比较少,一个分布点大多只有一种兜兰分布,其个体数量也不多。也就是说,野生兜兰居群的扩大,可能受到诸多因素的制约。下寨瞭望台附近的山顶只有硬叶兜兰,且居群比较集中,而下寨的其余三个分布点,也只有麻栗坡兜兰、白花兜兰或小叶兜兰,中论片区只有小叶兜兰。究其原因,一方面可能是因为喀斯特地区生态环境的空间差异非常大,虽同在一个保护区之内,甚至同一座山的不同坡位,其生态因子也有较大差异;另一方面,每种野生兜兰对生境可能有特定的要求,之所以能在一些片区找到野生兜兰的居群,说明不同野生兜兰均有适应不同环境的特殊方式,因而能够在特殊的环境中维持居群的相对稳定及物种的生存;第三,木论自然保护区的森林覆盖率较高 [18],野生兜兰的花粉和种子难以长距离传播;此外,木论自然保护区为喀斯特地形地貌,与土山丘陵地区相比,其林区内的湿度相对较低,经常遇到季节性干旱,传粉昆虫数量较少,因而影响其花粉的传播及居群数量的扩大,这也是木论保护区野生兜兰数量稀少的原因。
从小生境来看,麻栗坡兜兰通常生长在林下腐殖质丰富的土壤中,其生存环境与其他4种野生兜兰相比相对较好,其次是硬叶兜兰,而其余3种野生兜兰的生存环境则比较差,通常是生长在岩石缝隙之中,土壤瘠薄,水分缺乏,如果没有对岩溶环境的特殊适应方式,根本无法生存。
木论自然保护区5种野生兜兰根际土壤的pH在6.49~8.39之间,属于中性偏弱碱性。其根际土壤含水量、有机质、氮、磷、钾等含量与相邻的其他国家级自然保护区相比,属于中上水平 [38]。因为喀斯特岩溶地区具有地上地下二元空间结构,水分流失快,土壤保水能力较差,凋落物分解速度较慢,所以,土壤有机质相对比较丰富,同时,兰科植物具有根被等特殊结构且与真菌共生,叶片表面也具有较厚的几丁质或蜡层,可以有效防止水分的损失,因而能够很好地适应岩溶地区特殊的生境,这可能是喀斯特岩溶地区兰科植物物种比较丰富,但居群数量较小的原因。
4.2. 野生兜兰根际土壤微生物多样性存在较大差异
根据野生兜兰根际土壤细菌的测序结果可知:白花兜兰根际土壤细菌物种多样性及丰度与其他4种兜兰差异明显,说明每种野生兜兰根际土壤微生物类群有较大差异,这可能与不同兜兰分布的特殊生境有关。
从野生兜兰根际土壤真菌门水平分类图可知,帯叶兜兰根际土壤真菌的丰度较低,并且其样本中担子菌门占比较低,子囊菌门占比较高,与其它4种野生兜兰存在较大的差异,可能与其生长在石壁缝隙的特殊生境有关;其余4种野生兜兰根际土壤微生物在门水平的丰度一样,但在不同兜兰根际土壤微生物中,各个门类占比不同,在目水平及属水平多样性和丰度上也有较明显的差异,与野生兜兰共生的真菌目前尚不清楚。
5. 结论
根据以上实验数据及分析讨论,可以初步得到以下结论:
木论自然保护区不同野生兜兰的生境存在较大差异,其根际土壤理化性质及土壤微生物多样性均有较明显的差异,野生兜兰对岩溶地区不同生境具有特殊的适应方式,土壤微生物对其有效利用环境资源具有重要的作用,因而对野生兜兰生存能力的提高和居群扩大具有重要影响。
因为喀斯特岩溶地区的生态环境十分脆弱,所以野生兜兰的生境一旦遭到严重的干扰破坏,其生存及居群扩大将极为困难。因此,应提高人们的环境意识,切实加以保护。
基金项目
桂西北地方资源保护与利用工程中心资助项目(桂教科研[2012] 9号),桂西北岩溶地区石漠化综合防治实验室资助项目(校政发[2016] 91号),河池学院高层次人才科研启动费项目(XJ2018GKQ016),广西高校大学生创新创业训练计划项目(201910605097)。
NOTES
*通讯作者。