修回日期: 2006-03-16
接受日期: 2006-03-20
在线出版日期: 2006-05-28
目的: 构建胃癌相关基因GCRG213正、反义真核表达载体.
方法: 从pGEM-T质粒上扩增出的胃癌相关基因GCRG213的DNA片段, 两端分别引入限制性内切酶KpnI, BamHI和EcoRI, BamHI识别位点, 按正向、反向克隆入真核表达载体pcDNA3.1(+). 测序正确的重组子pcDNA3.1-a(含GCRG213正向克隆), pcDNA3.1-b(含GCRG213反向克隆)和空载体经脂质体转染人胃癌细胞系MKN45细胞, G418筛选获得稳定转染的细胞株, 采用半定量RT-PCR及Western blot比较转染不同质粒的MKN45细胞中GCRG213在mRNA和蛋白质水平上的表达差异.
结果: 经测序证实, GCRG213正向克隆和反向克隆正确插入真核表达载体pcDNA3.1(+), 组成重组子pcDNA3.1-a(含正向克隆), pcDNA3.1-b(含反向克隆). 重组子pcDNA3.1-a, pcDNA3.1-b和空载体经脂质体转染人胃癌细胞系MKN45细胞, G418筛选获得稳定转染的细胞株. 与对应的空载体比较, RT-PCR结果显示转染pcDNA3.1-a的MKN45细胞中其mRNA的表达上调35.4%, 而转染pcDNA3.1-b的MKN45细胞中其mRNA的表达下调32.1%; Western blot结果显示转染pcDNA3.1-a的MKN45细胞中其蛋白的表达上调49.4%, 而转染pcDNA3.1-b的MKN45细胞中其蛋白的表达下调50.3%.
结论: 成功构建胃癌相关基因GCRG213正、反义真核表达载体.
引文著录: 高利利, 吴本俨, 王孟薇, 黄海力, 伍银桥, 尤纬缔, 王卫华. 胃癌相关基因GCRG213正反义真核表达载体的构建及鉴定. 世界华人消化杂志 2006; 14(15): 1453-1457
Revised: March 16, 2006
Accepted: March 20, 2006
Published online: May 28, 2006
AIM: To construct and identify the gastric cancer associated gene GCRG213 eukaryotic expression vector.
METHODS: The sense and anti-sense fragment of GCRG213 were obtained by polymerase chain reaction (PCR), which were GCRG213-a and GCRG213-b respectively. They were cloned into eukaryotic expression vector pcDNA3.1(+) after introduced the sites of restrictive endonuclease enzyme KpnI, BamHI and EcoRI, BamHI. The recombinant plasmid pcDNA3.1-a, pcDNA3.1-b and the vector pcDNA3.1 were transfected separately into MKN45 cells conducted by lipofectamineTM 2000. G418 selection was used to obtain the stably transfected cells. The expression of GCRG213 was detected at both mRNA and protein level with semi-quantitative reverse transcription PCR (RT-PCR) and Western blot, respectively.
RESULTS: After sequencing, sense GCRG213 and anti-sense GCRG213 were confirmed to be successfully cloned into eukaryotic expression vector pcDNA3.1, which were named pcDNA3.1-a and pcDNA3.1-b correspondingly. The recombinant plasmid pcDNA3.1-a, pcDNA3.1-b, and the vector pcDNA3.1 were transfected successfully into MKN45 cells by lipofectamineTM 2000. After G418 selection, the stably transfected cells were obtained. Transfection with pcDNA3.1-a significantly increased the expression of GCRG213 in MKN45 cells both at mRNA (35.4%) and protein (49.4%) level, while transfection of pcDNA3.1-b significantly decreased the expression of GCRG213 both at mRNA (32.1%) and protein (50.3%) level.
CONCLUSION: The eukaryotic expression vector of gastric cancer associated gene GCRG213 is successfully constructed and identified.
- Citation: Gao LL, Wu BY, Wang MW, Huang HL, Wu YQ, You WD, Wang WH. Construction and identification of eukaryotic expression vector of gastric cancer associated gene GCRG213. Shijie Huaren Xiaohua Zazhi 2006; 14(15): 1453-1457
- URL: https://www.wjgnet.com/1009-3079/full/v14/i15/1453.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i15.1453
胃癌是严重威胁人类健康的重要疾患之一, 其发生和发展是多基因变异累积的过程. 我们应用荧光标记的DDRT-PCR筛选出一条在肠型胃癌组织、癌旁和正常组织间差异表达的新基因GCRG213, 生物信息学分析表明他具有完整的开放阅读框架, 编码含有142个氨基酸的产物. 原位杂交和Northern blot显示该基因在胃癌和癌旁不典型增生组织高表达, 正常胃组织低表达. 制备多克隆抗体初步检测表明该基因在胃癌、癌旁、正常组织中有蛋白水平的表达差异. 经过同源比对, 该基因与机体中碱基切除修复的关键酶APE/Ref-1序列有61%, 同源性并且含有其保守区的功能位点[1].
无嘌呤无嘧啶核酸内切酶(apurinic/apyrimidinic endonucleas, APE)是一种具有DNA修复与氧化还原双功能的蛋白, 人体APE由Ref-1基因编码, APE/Ref-1是碱基切除修复(base excision repair, BER)通路的关键酶, 能够修复机体受内外环境影响产生的AP位点[2]. APE的氧化还原功能可调节许多转录因子DNA结合活性, 与细胞的增殖、分化、损伤修复有关[3]. 近年来研究发现Ref-1基因是一种肿瘤相关基因. 由于GCRG213与APE/Ref-1有同源性, 并且具有该蛋白重要的功能位点, 因此可能是其一个新的变异体. 该变异体在胃癌和癌前不典型增生组织中mRNA和蛋白水平表达高于正常胃黏膜, 说明他参与了胃癌的发生、发展过程, 可能是影响胃癌细胞生物学特性的重要功能基因.
我们采用分子克隆及基因转染技术将GCRG213基因转入哺乳动物细胞, 以期望能对GCRG213基因的功能有一初步了解.
pGEM-T质粒含GCRG213 cDNA 1094 bp, 其中开放阅读框架426 bp, 为本实验室构建保存. MKN45细胞为本实验室保存, 在37 ℃, 50 mL/L CO2的孵箱中常规培养. 限制性内切酶(KpnⅠ, BamHⅠ, EcoRⅠ)和T4连接酶购自日本宝生物(TaKaRa)工程有限公司. 真核表达载体pcDNA3.1(+)为本实验室保存. 琼脂糖凝胶DNA回收试剂盒、高纯度质粒小量提取试剂盒、总RNA提取试剂盒和DH5α感受态细胞购自北京天为时代科技有限公司. 脂质体(LipofectamineTM 2000)购自美国Gibco公司. G418购自美国Sigma公司. DMEM培养基、RT-PCR试剂盒为美国Gibco公司产品. 胎牛血清购自北京鼎国生物工程公司. 羊抗人β-actinmAb、HRP标记的羊抗兔二抗、HRP标记的兔抗羊二抗购自北京中杉金桥生物技术有限公司. 兔抗人GCRG213多克隆抗体为本实验室保存. 低分子质量蛋白质标准购自北京天为时代科技有限公司. 预染蛋白分子量标准购自New England 公司. ECL Western blot检测试剂盒购自美国Santa Cruz公司. 其余试剂均为国产或进口分析纯试剂.
采用Primer 5.0软件设计引物, 选取了GCRG213序列中包含有开放阅读框架(ORF)的序列作为扩增序列, 根据真核表达载体pcDNA3.1(+)的要求, 引物序列如下: 正向克隆(a)引物P1: 5'-GGGGTACCATGCAACAAGAAGAGCTA-3', P2: 5'-CGGGATCCTCAGTTTTGAGTGAGCTTC-3'; 反向克隆(b)引物P1: 5'-AAGAATTCATGCAACAAGAAGAGCTA-3', P2: 5'-CGGGATCCTCAGTTTTGAGTGAGCTTC-3'(产物预计长度445 bp), 由上海博亚生物工程公司合成. PCR扩增靶DNA片段, 反应条件为: 94 ℃ 2 min. 94 ℃ 30 s, 51 ℃ 30 s, 72 ℃ 30 s, 32个循环. 72 ℃延伸7 min. 采用清华大学天为时代科技公司PCR产物纯化试剂盒对PCR产物进行纯化回收. 取纯化DNA 5 µL, 以10 g/L琼脂糖凝胶电泳分析. 纯化后DNA需要经紫外分光光度计检测样品的A260和A280, 以确定样品DNA的含量. PCR纯化产物经KpnⅠ, BamHⅠ和EcoRⅠ, BamHⅠ分别双酶切后, 琼脂糖凝胶电泳回收纯化. 真核表达载体pcDNA3.1(+)同样经KpnⅠ, BamHⅠ和EcoRⅠ, BamHⅠ分别双酶切后回收纯化. GCRG213的酶切纯化产物与真核表达载体pcDNA3.1(+)的酶切纯化产物按3:1的比例混合, 加入T4连接酶进行连接反应(16 ℃过夜), 重组子(pcDNA3.1-a, pcDNA3.1-b)转化DH5α感受态细胞, 涂布具有氨苄青霉素(100 mg/L)的LB琼脂平板, 于37 ℃培养过夜. 挑取单个菌落以PCR、内切酶切割、测序依次鉴定之. 使用LipofectamineTM2000脂质体转染试剂并按其说明书方法进行. 将MKN45细胞接种于6孔板, 待细胞数量达到90%-95%汇合后进行瞬时转染, 每孔分别加入10 µL LipofectamineTM2000转染试剂和对应质粒, 在50 mL/L CO2培养箱中37 ℃保温24 h, 将细胞按1:10的稀释比例传代至含100 mL/L FBS的DMEM培养基中, 再培养1 d后换用含G418(500 mg/L)的完全培养基常规培养, 每3-4 d更换培养液, 每日观察细胞生长情况, 抗性细胞集落形成后, 用含半量筛选浓度G418(250 mg/L)的完全培养基扩大培养. 在此后的实验过程中, 间断地取出部分细胞在含500 mg/L的G418的条件培养基中筛选, 未能稳定转染的细胞在6-8 d全部死亡, 转基因MKN45细胞却能持续存活并生长传代.
1.2.1 半定量RT-PCR检测转染细胞中GCRG213 mRNA的表达: 采用总RNA提取试剂盒, 按操作说明提取转染细胞的总RNA. 紫外检测仪分别在260 nm和280 nm波长下检测RNA的吸光度值, 测定RNA的纯度, 并用甲醛变性电泳实验检测RNA的完整性. 取RNA 4 µg进行逆转录, 然后各自取cDNA 1 µL用于PCR反应. GCRG213基因引物序列如下: P1: 5'-AACTGCAGATGCAACAAGAA-3', P2: 5'-CGGGATCCAAGTTTTGAGTGAG-3'; 以β-肌动蛋白(β-actin)为内参照, 引物序列如下: P1: 5'-GCTCCGGCATGTGCAAGG-3', P2: 5'-ATGTCACGCACGCTTTCC-3'. PCR引物由上海博亚生物工程公司合成. 反应条件: 94 ℃ 2 min. 94 ℃ 30 s, 51 ℃ 30 s, 72 ℃ 30 s, 30个循环. 72 ℃延伸7 min. 取反应液5 mL, 以10 g/L琼脂糖凝胶电泳分析. 产物电泳后经凝胶分析软件(Bandscan)分析其灰度值, 结果以产物与内参照的比值表示.
1.2.2 Western blot检测转染细胞GCRG213蛋白的表达: SDS-聚丙烯酰胺凝胶(SDS-PAGE)电泳, 按照《分子克隆实验指南》灌制120 g/L的不连续SDS-PAGE, 分别取3组转染细胞裂解液样品(每个均取细胞蛋白100 mg)加样后电泳, 湿式电转移, 封闭, 第1抗体结合, 第2抗体结合, ECL法显影. 以β-actin为内参照. 经凝胶分析软件(Bandscan)分析其灰度值, 结果以产物与内参照的比值表示.
统计学处理 成组t检验(SPSS 11.0软件包).
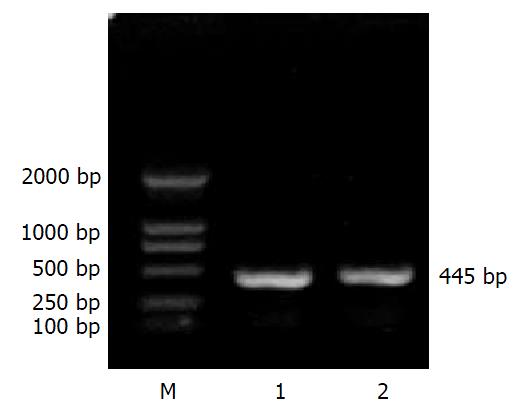
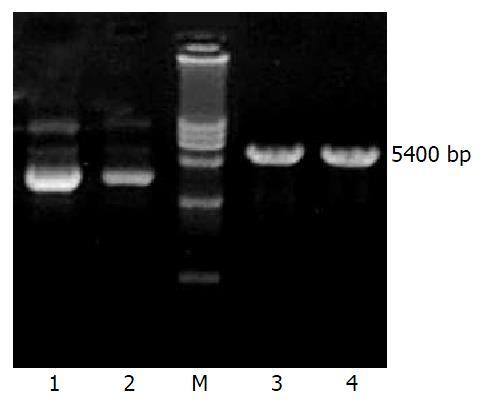
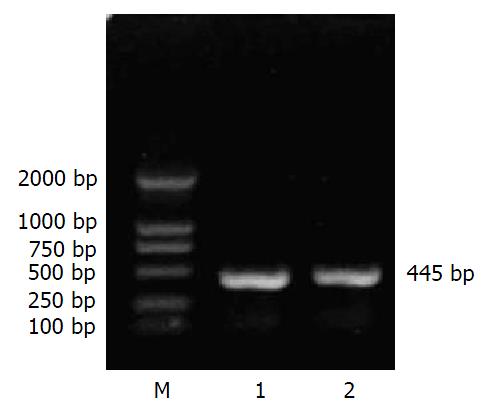
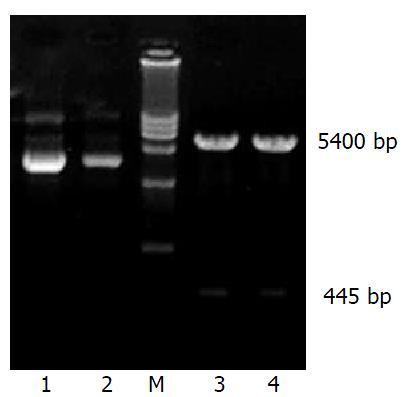
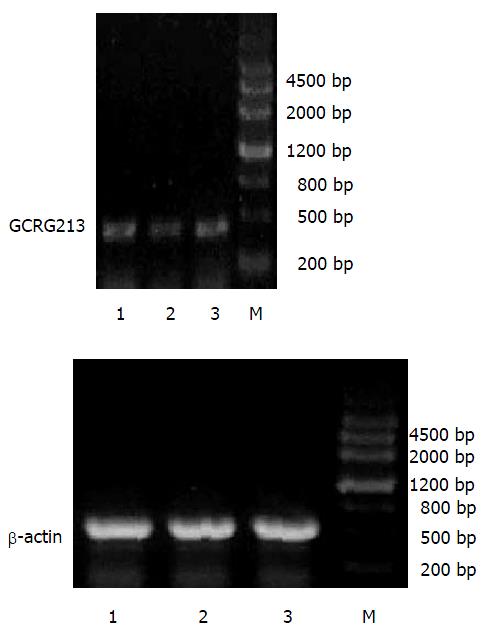
GCRG213正向、反向克隆的PCR产物(a, b)经10 g/L琼脂糖凝胶电泳, 可见在445 bp处各有一条特异的扩增产物, 与预计长度相符(图1). 真核表达载体pcDNA3.1(+)载体分别应用限制性内切酶KpnⅠ, BamHⅠ和EcoRⅠ, BamHⅠ双酶切, 产物经10 g/L低熔点琼脂糖凝胶纯化、回收, 在5400 bp处有一特异条带, 与理论值相符(图2). pcDNA3.1-a, pcDNA3.1-b重组质粒经相应的引物PCR扩增后, 经10 g/L琼脂糖凝胶电泳, 可见在445 bp处各有一条特异的扩增产物, 与预计长度相符. pcDNA3.1-a, pcDNA3.1-b重组质粒分别经限制性内切酶KpnⅠ, BamHⅠ和EcoRⅠ, BamHⅠ双酶切, 产物经10 g/L琼脂糖凝胶电泳, 分别在5400 bp处和445 bp处有一特异条带, 与理论值相符(图3-4).
RT-PCR法检测结果表明, 与转染空载体的MKN45细胞相比, 转染GCRG213正向克隆的MKN45细胞中其mRNA的表达上调35.4%, 而转染反向克隆的MKN45细胞中其mRNA的表达下调32.1%. MKN45-213a, MKN45-213b, MKN45-pcDNA3.1 mRNA表达量分别为0.328±0.05, 0.144±0.013, 0.212±0.016(图5).
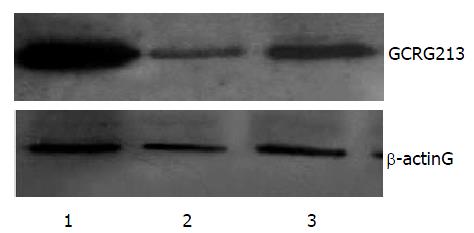
Western blot检测结果表明, 与转染空载体的MKN45细胞相比, 转染GCRG213正向克隆的MKN45细胞中其蛋白的表达上调49.4%, 而转染反向克隆的MKN45细胞中其蛋白的表达下调50.3%. MKN45-213a, MKN45-213b, MKN45-pcDNA3.1蛋白表达量分别为3.42±0.05, 0.861±0.013, 1.732±0.016(图6).
我们采用真核表达载体pcDNA3.1作为胃癌相关基因GCRG213转染的载体, GCRG213基因正向克隆和反向克隆插入到pcDNA3.1的KpnⅠ, BamHⅠ和EcoRⅠ, BamH酶切位点之间, 构建了GCRG213的正义和反义真核表达载体. 我们提取3种稳定转染的MKN45细胞总RNA, 采用RT-PCR方法观察不同转染细胞中GCRG213 mRNA水平的表达差异. 与转染空载体的MKN45细胞相比, 转染GCRG213正向克隆的MKN45细胞中其mRNA的表达上调35.4%, 而转染反向克隆的MKN45细胞中其mRNA的表达下调32.1%, 以上结果提示, 正向克隆的转染增加了相应基因的转录, 而反向克隆的转染则抑制了相应基因的转录.
Western blot首先提取转染细胞的蛋白质, 通过SDS-聚丙烯酰胺凝胶电泳, 将提取的蛋白质浓缩并由于凝胶的分子筛作用和带负电的SDS-蛋白质复合物在凝胶电泳中向正极迁移, 分离不同大小分子质量的蛋白质, 再转移至固相支持体, 通过蛋白特异性的多克隆抗体, 检测转染细胞GCRG213蛋白的表达. 蛋白质的Western blot技术结合了凝胶电泳的高分辨率和固相免疫测定的特异性、敏感性, 可检测到低至1-5 ng中等大小的蛋白质[4]. 本实验中, Western blot结果为: 与转染空载体的MKN45细胞相比, 转染GCRG213正向克隆的MKN45细胞中其蛋白的表达上调49.4%, 而转染反向克隆的MKN45细胞中其蛋白的表达下调50.3%, 以上结果提示, 正向克隆的转染增加了GCRG213蛋白的表达, 而反向克隆转染则抑制了GCRG213蛋白的表达.
BLAST分析显示GCRG213与APE/Ref-1序列有61%同源性, 并且含有其C'末端保守区[1]. APE/Ref-1主要参与由于氧化性损伤造成的DNA损害的修复; 同时, APE/Ref-1也是一种氧化还原因子, 调节转录因子的DNA结合活性. DNA修复机制异常是癌症进展过程中常见的现象. 人体APE由Ref-1基因编码, 编码的蛋白命名为APE/Ref-1或者HAP1. Ref-1基因是一种肿瘤相关基因. Ref-1对一种苯衍生的DNA复合物1, N6-benzetheno-dA(p-BQ-dA)具有序列依赖性, 提示Ref-1在苯诱导的致癌过程中发挥作用[5]. Herring et al[6]研究了人宫颈癌促克隆形成细胞与APE/Ref-1蛋白表达的关系, 发现肿瘤活检组织的促克隆形成细胞与APE/Ref-1蛋白表达之间存在中等程度的显著正相关(r = 0.60, P = 0.002). APE/Ref-1能激活一些氧化的原癌基因, 在卵巢癌、宫颈癌、前列腺癌、横纹肌肉瘤、生殖细胞肿瘤等多种肿瘤中APE/Ref-1表达增强[7]. 我们成功构建胃癌相关基因GCRG213正、反义真核表达载体, 为下一步研究胃癌相关基因GCRG213的功能奠定了基础.
胃癌是严重威胁人类健康的重要疾患之一, 其发生和发展是多基因变异累积的过程. 近年来研究发现Ref-1基因是一种肿瘤相关基因. 由于GCRG213与APE/Ref-1有同源性, 并且具有该蛋白重要的功能位点, 因此可能是其一个新的变异体. 本文采用分子克隆及基因转染技术将GCRG213基因转入哺乳动物细胞, 成功构建胃癌相关基因GCRG213正、反义真核表达载体, 为下一步研究胃癌相关基因GCRG213的功能奠定了基础.
本研究构建了胃癌相关基因GCRG213的正、反义真核表达载体, 建立了稳定转染的MKN45细胞株, 并采用半定量RT-PCR及Western blot比较转染不同质粒的MKN45细胞中GCRG213在mRNA和蛋白质水平上的表达差异. 研究设计合理, 方法可行, 结果充实, 结论较为明确, 为下一步研究胃癌相关基因GCRG213的功能奠定了一定基础.
电编:张敏 编辑:潘伯荣
| 1. | Wang GS, Wang MW, Wu BY, Liu XB, You WD, Yang XY. A gene encoding an apurinic/apyrimi-dinic endonuclease-like protein is up-regulated in human gastric cancer. World J Gastroenterol. 2003;9:1196-1201. [PubMed] [DOI] |
| 2. | Wilson DM 3rd, Barsky D. The major human abasic endonuclease: formation, consequences and repair of abasic lesions in DNA. Mutat Res. 2001;485:283-307. [PubMed] [DOI] |
| 3. | Kakolyris S, Kaklamanis L, Giatromanolaki A, Koukourakis M, Hickson ID, Barzilay G, Turley H, Leek RD, Kanavaros P, Georgoulias V. Expression and subcellular localization of human AP endonuclease 1 (HAP1/Ref-1) protein: a basis for its role in human disease. Histopathology. 1998;33:561-569. [PubMed] [DOI] |
| 4. | 沈 关心, 周 汝麟. 现代免疫学实验技术. 第2版. 武汉: 湖北科学技术出版社 2002; 554-555. |
| 5. | Hang B, Chenna A, Sagi J, Singer B. Differential cleavage of oligonucleotides containing the benzene-derived adduct, 1, N6-benzetheno-dA, by the major human AP endonuclease HAP1 and Escherichia coli exonuclease III and endonuclease IV. Carcinogenesis. 1998;19:1339-1343. [PubMed] [DOI] |
| 6. | Herring CJ, Deans B, Elder RH, Rafferty JA, MacKinnon J, Barzilay G, Hickson ID, Hendry JH, Margison GP. Expression levels of the DNA repair enzyme HAP1 do not correlate with the radiosensitivities of human or HAP1-transfected rat cell lines. Br J Cancer. 1999;80:940-945. [PubMed] [DOI] |
| 7. | Fritz G. Human APE/Ref-1 protein. Int J Biochem Cell Biol. 2000;32:925-929. [PubMed] [DOI] |