Abstract
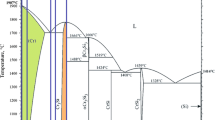
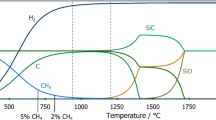
The composition of the products of carbothermal reduction of Sc2O3 is examined by X-ray diffraction and chemical analysis and by the hydrolysis method. At pressures of 10−2-1 Pa, the reaction starts in the temperature region of 1 000–1 200°C. The first product is Sc2OC of NaCl type; at 1 Pa and 1 400–1 500°C this substance is formed quantitatively (according to stoichiometry) within 50–100 h, repeated homogenization, however, is necessary, or else Sc2OC reacts locally with Sc2O3 giving Sc2O1+x C1−x . The lattice parameter of Sc2OC in the presence of Sc15C19 is 457.63pm. At temperatures above 1 500°C, Sc15C19 is incompletely formed by subsequent reaction with carbon. The product melts at cca. 1 800°C; carbon dissolves and the final composition approaches ScC2. Carbon separates during solidification. The phase fractions in the products are affected by evaporation, the vapour pressures above both Sc2OC and Sc15C19 being comparable with the pressure requisite for the carboreduction process. The results are discussed with respect to the often ambiguous published data.
Zusammenfassung
Zur Untersuchung von Produkten der karbothermischen Reduktion von Scandiumoxid wurden sowohl röntgenographische und chemische Analyse als auch die hydrolytische Methode verwendet. Bei 10−2 bis 1 Pa beginnt die Reaktion im Temperaturintervall von 1 000–1 200°C. Das erste Reaktionsprodukt ist das Scandiumoxidcarbid Sc2OC von NaCl-Typ, das quantitativ (der Stöchiometrie entsprechend) bei 1 400–1 500°C und 1 Pa in 50–100 Stunden entsteht. Eine wiederholte Homogenisierung ist allerdings notwendig, damit es zu keiner lokalen Reaktion zwischen Sc2OC und Sc2O3 kommt, bei der dann die Phase Sc2O1+x C1−x entsteht. In Gegenwart von Sc15C19 ist der Gitterparameter von Sc2OCa=457.63pm. Über 1 500°C führt eine weitere Reaktion mit Kohlenstoff zu einer nicht ganz vollendeten Bildung von Sc15C19. Bei cca. 1 800°C schmilzt das Reaktionsprodukt bei gleichzeitiger Auflösung von weiterem Kohlenstoff und die Zusammensetzung nähert sich der Formel ScC2, beim Erstarren fällt der Kohlenstoff wieder aus. Die Verteilung der Phasen im Produkt wird von der Verdampfung beeinflußt, da die Dampfdrucke von Sc2OC und Sc15C19 mit dem zum Karboreduktionverlauf notwendigen Druck vergleichbar sind. Die erhaltenen Ergebnisse werden in Relation mit den nicht eindeutigen Angaben in der Literatur diskutiert.
Similar content being viewed by others
References
Chupka WA, Berkowitz I, Giese CF, Ingram MG (1958) J Phys Chem 62: 611
Wagner S (1968) Dissertation, University of Vienna
Petrů F, Brožek V, Hájek B, Dufek V (1969) Z Chem 9: 71
Petrů F, Brožek V, Hájek B (1970) Rév Chim Miner 7: 515
Hájek B, Brožek V, Mostecký J (1971) Monatsh Chem 102: 1387
Auer-Welsbach H, Nowotny H (1961) Monatsh Chem 92: 198
Samsonov GV, Makarenko GI, Kosolapova TYa (1962) Dokl Akad Nauk SSSR 144: 1062
Zhurakovski EA, Dzeganovski VP (1963) Dokl Akad Nauk SSSR 150: 1260
Petrů F, Hájek B, Brožek V (1966) Z Chem 6: 32
Jedlicka H, Nowotny H, Benesovsky F (1971) Monatsh Chem 102: 389
Fridrich E, Sittig L (1925) Z Anorg Allg Chem 143: 293
Nowotny H, Auer-Welsbach H (1961) Monatsh Chem 92: 789
Rassaerts H, Nowotny H, Vinek G, Benesovsky F (1967) Monatsh Chem 98: 460
Krikorian NH, Bowman AL, Krupka MC, Arnold GP (1969) High Temp Sci 1: 360
Atoji M, Kukuchi M (1969) J Chem Phys 51: 3863
Hájek B, Karen P, Brožek V (1982) Proc. 38th Conf Czech Chem Soc, Prague, Czechoslovakia, July 6–9, p 64
Hájek B, Karen P, Brožek V (1984) J Less-Common Met 96: 35
Hájek B, Karen P, Brožek V (1984) J Less-Common Met 98: 245
Karen P, Brožek V, Hájek B (1985) Sci Pap Inst Prague Chem-Technol. B 30: 31
Karen P, Brožek V, Hájek B (1985) Extended Abstracts of VIII. Int. Conf. of Solid Compds of Trans. Elements, Vienna, Austria, April 9–13, p P 2 A 7
Řehák B, Brožek V (1972) Sci Pap Prague Inst Chem-Technol. B 14: 113
Brožek V (1976) Sci Pap Inst Prague Chem-Technol B 21: 7
Petrů F, Koloč J, Brožek V, Mrňák L, Pešek J (1969) Czech. Pat. No. 144116 (16. 1. 1969)
Hájek B, Karen P, Brožek V (1984) Collect Czech Chem Commun 49: 936
Holcombe CE,Carpenter DA (1981) J Amer Ceram Soc 64: C-82
Hájek B, Karen P, Brožek V (1984) Collect Czech Chem Commun 49: 944
Haschke JM, Eick HA (1970) Inorg Chem 9, 851
Lubimov VD, Alamovskii SI, Shveikin GP (1981) Zh. Neorg. Khim. 26: 2314
Potter PE (1972) J Nucl Matter 42: 1
Bauer J, Nowotny H (1971) Monatsh Chem 102: 1129
Bauer J, Ansel D (1985) J Less-Common Met 109: 345
Bauer J (1974) J Less-Common Met 37: 161
Haschke JM, Eick HA (1970) J Amer Chem Soc 92: 1526
Bauer J, Bienvenu H (1980) CR Acad Sci Ser C 290: 387
Vannerberg N-G (1962) Acta Chem Scand 16: 1212
Krupka MC, Giorgi AL, Krikorian NH, Sklarz EG (1969) J Less-Common Met 17: 91
Novokshonov VI (1980) Zh Neorg Khim 25: 684
Krupka MC, Giorgi AL, Szklarz EG (1973) J Less-Common Met 30: 217
Krupka MC, Giorgi AL, Krikorian NH, Szklarz EG (1969) J Less-Common Met 19: 113
Giorgi AL, Szklarz EG, Krikorian NH, Krupka MC (1970) J Less-Common Met 22: 131
Hägg G (1929) Z Phys Chem Abt B 6: 221
Hägg G (1931) Z Phys Chem Abt B 12: 33
Jacobsen B, Westgren A (1933) Z Phys Chem Abt B 20: 361
Hume-Rothery W (1953) Phil Mag 44: 1154
Nowotny H, Neckel A (1969) J Inst Metals 97: 2519
Author information
Authors and Affiliations
Rights and permissions
About this article
Cite this article
Hájek, B., Karen, P. & Brožek, V. Studies on hydrolyzable carbides. XXII: The carbothermal reduction of scandium oxide Sc2O3 . Monatsh Chem 117, 1271–1278 (1986). https://doi.org/10.1007/BF00810872
Received:
Revised:
Accepted:
Issue Date:
DOI: https://doi.org/10.1007/BF00810872