修回日期: 2016-05-15
接受日期: 2016-05-23
在线出版日期: 2016-06-18
目的: 观察贝伐珠单抗联合化疗治疗转移性结直肠癌(metastatic colorectal cancer, mCRC)的疗效和安全性.
方法: 回顾分析2012-01/2015-07在新疆肿瘤医院接受贝伐珠单抗联合化疗的mCRC患者71例, 观察其临床疗效和贝伐珠单抗相关的不良反应. 至少2个周期贝伐珠单抗治疗后评估疗效, 每周期治疗后记录不良反应.
结果: 71例mCRC患者, 客观缓解率(response rate, RR)为29.6%, 疾病控制率(disease control rate, DCR)为78.9%. 一线治疗组RR为35.6%, DCR为88.9%. 二线治疗组RR为19.2%, DCR为61.5%. 一线治疗组中位无进展生存时间(median progress-free survival, mPFS)和中位总生存时间(median overall survival, mOS)分别为8.2 mo和20.9 mo. 二线治疗组的mPFS和mOS分别为4.4 mo和14.7 mo. 一线化疗后接受维持治疗与未接受维持治疗的mPFS分别为11.7 mo和7.7 mo(P<0.0001). 与贝伐珠单抗治疗相关的不良反应主要为高血压、蛋白尿和出血等, 绝大多数为l-2级.
结论: 本研究表明贝伐珠单抗联合化疗对mCRC患者是获益的, 一线使用贝伐珠单抗联合化疗能带来更长生存, 维持治疗可延缓病情进展. 与贝伐珠单抗治疗相关的不良反应较轻, 患者的耐受性较好.
核心提示: 我国的结直肠癌发病率上升较快, 而有远处转移的结直肠癌患者, 其5年生存率仅为10%. 靶向药物联合化疗已成为转移性结直肠癌患者治疗的重要选择. 贝伐珠单抗因具有高效、安全和良好的药物经济性等多重优势, 临床研究表明贝伐珠单抗联合化疗在转移性结直肠癌一线、二线、跨线、维持治疗使用均带来生存获益.
引文著录: 曲颜丽, 赛福丁•克尤木, 唐勇. 贝伐珠单抗联合化疗治疗转移性结直肠癌的疗效和安全性. 世界华人消化杂志 2016; 24(17): 2748-2754
Revised: May 15, 2016
Accepted: May 23, 2016
Published online: June 18, 2016
AIM: To assess the efficacy and safety of bevacizumab combined with chemotherapy in the treatment of metastatic colorectal cancer (mCRC).
METHODS: Seventy-one patients with mCRC treated with bevacizumab combined with chemotherapy at the Affiliated Tumor Hospital of Xinjiang Medical University from January 2012 to July 2015 were retrospectively analyzed. Clinical efficacy and bevacizumab-related adverse reactions were observed. Efficacy assessment was conducted after at least 2 cycles of bevacizumab therapy. Adverse reactions were recorded in each therapy cycle.
RESULTS: Of 71 patients with mCRC, the response rate (RR) was 29.6% and disease control rate (DCR) was 78.9%. RR and DCR were 35.6% and 88.9% in the first-line treatment group, respectively, and 19.2% and 61.5% in the second-line treatment group, respectively. Median PFS and OS were 8.2 and 20.9 mo in the first-line treatment group, respectively, and 4.4 and 14.7 mo in the second-line treatment group, respectively. PFS of patients with or without maintenance therapy after the first-line treatment was 11.7 and 7.7 mo, respectively (P < 0.0001). Adverse events related to bevacizumab included hypertension, proteinuria and hemorrhage, which were mostly grade l-2.
CONCLUSION: Treatment of mCRC with bevacizumab plus chemotherapy is effective. The initiation of bevacizumab in the first-line treatment provides long-term survival. The PFS of patients receiving maintenance treatment with bevacizumab is better than that of patients without maintenance treatment. Bevaeizumab-related toxicity is mild and can be well tolerated.
- Citation: Qu YL, Saifuding•Keyoumu, Tang Y. Efficacy and safety of bevacizumab combined with chemotherapy in treatment of metastatic colorectal cancer. Shijie Huaren Xiaohua Zazhi 2016; 24(17): 2748-2754
- URL: https://www.wjgnet.com/1009-3079/full/v24/i17/2748.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i17.2748
结直肠癌是常见恶性肿瘤之一, 近年来我国结直肠癌发病呈快速上升趋势, 据中国恶性肿瘤发病和死亡分析显示2012年结直肠癌发病率居第4位, 死亡率居第5位[1]. 确诊为结直肠癌的患者大约50%-60%发生转移, 而且其中的80%-90%为不可切除肝转移, 需要接受全身治疗. 临床研究显示靶向联合化疗使转移性结直肠癌(metastatic colorectal cancer, mCRC)患者生存可延长至30 mo[2], 指南推荐单纯化疗或与靶向药物联合是姑息化疗基本方案.
血管生成是肿瘤发生发展的关键驱动因素, 血管生成的关键调节因素是血管内皮生长因子(vascular endothelial growth factor, VEGF)和其受体的相互作用. 贝伐珠单抗作为人源化单克隆抗VEGF抗体, 通过阻止VEGF与受体的结合, 抑制肿瘤新生血管生成和内皮细胞增殖, 起到抗肿瘤作用[3]. 由于AVF2107研究[4]结果FDA于2004年批准贝伐珠单抗联合IFL作为mCRC一线化疗治疗. 而后多项RCT研究[4-10]表明贝伐珠单抗联合化疗在mCRC的各线及维持治疗中均有一定的疗效. 本研究回顾性分析新疆肿瘤医院2012-01/2015-07使用贝伐珠单抗联合化疗治疗71例mCRC患者的治疗效果和安全性, 现将总结如下.
收集新疆肿瘤医院2012-01/2015-07收治的应用贝伐珠单抗联合化疗治疗mCRC患者共71例, 患者均有经影像学证实的临床可评价的客观指标, 且接受至少2周期的贝伐珠单抗联合化疗. 所有患者心、肝、肾、骨髓功能基本正常, 心电图基本正常. 其中男性40例(56.3%), 女性31例(43.7%); 中位年龄56岁; 最为常见的远处转移为肝转移(70.4%). 患者基本情况如表1.
| 项目 | n | 百分比(%) |
| 性别 | ||
| 男 | 40 | 56.3 |
| 女 | 31 | 43.7 |
| 年龄(岁) | ||
| 年龄范围 | 38-76 | |
| 中位年龄 | 56 | |
| ECOG评分(分) | ||
| 0 | 34 | 47.9 |
| 1 | 35 | 49.3 |
| 2 | 2 | 2.8 |
| 原发肿瘤部位 | ||
| 结肠 | 30 | 42.3 |
| 直肠 | 41 | 57.7 |
| 病理类型 | ||
| 高中分化 | 51 | 71.8 |
| 低分化 | 16 | 22.5 |
| 黏液、印戒 | 4 | 5.6 |
| 肿瘤转移部位 | ||
| 肝 | 50 | 70.4 |
| 肺 | 30 | 42.3 |
| 腹膜 | 10 | 14.1 |
| 淋巴结 | 21 | 29.6 |
| 骨 | 12 | 16.9 |
| 其他 | 16 | 22.5 |
| 原发病灶手术切除 | ||
| 否 | 24 | 33.8 |
| 是 | 47 | 66.2 |
1.2.1 治疗: 患者均采用贝伐珠单抗联合化疗, 化疗方案为FOLFOX、XELOX、FOLFIRI、XELIRI、单药卡培他滨, 贝伐珠单抗为NCCN推荐根据化疗方案给予7.5 mg/kg, 每3 wk重复给药方案, 或5 mg/kg, 每2 wk重复给药方案. 具体如下: (1)mFOLFOX6方案: 奥沙利铂(OXA)85 mg/m2 d1, 甲酰四氢叶酸(LV)200 mg/m2 d1, 5-氟尿嘧啶(5-Fu)400 mg/m2 d1, 5-Fu 2400 mg/m2 civ 46 h, q2w; (2)XELOX方案: OXA 130 mg/m2 d1, 卡培他滨(Cape)1000 mg/m2bid d1-14, q3w; (3)FOLFIRI方案: 伊立替康(CPT-11)180 mg/m2 d1, LV 200 mg/m2 d1, 5-Fu 400 mg/m2 d1, 5-Fu 2400 mg/m2 civ 46 h, q2w; (4)XELIRI方案: CPT-11 100-120 mg/m2 d1、8, Cape 1000 mg/m2 d1-14, q3w; (5)单药卡培他滨(Cape)方案: Cape 1250 mg/m2 d1-14, q3w.
1.2.2 疗效及不良反应评价标准: 按RECIST1.1实体肿瘤疗效评价标准进行疗效评价, 分为: 完全缓解(complete response, CR)、部分缓解(partial response, PR)、疾病稳定(stable disease, SD)、疾病进展(progressive disease, PD). 以CR+PR计算有效率(response rate, RR), 以CR+PR+SD计算疾病控制率(disease control rate, DCR). 无进展生存时间(progress-free survival, PFS): 化疗开始至肿瘤出现进展或发生因为任何原因的死亡之间的这段时间. 总生存时间(overall survival, OS): 从化疗开始至死亡或末次随诊时间. 随访时间为治疗开始至随访截止日期、患者失访或死亡的时间. 不良反应按照美国国立癌症研究所常见毒性分级标准3.0版(NCI-CTC 3.0)进行评价. 对于2 wk方案的患者, 每3个周期行疗效评价. 每个周期均进行不良反应评价.
1.2.3 随访: 随访方式为电话随访, 随访时间为治疗开始至末次随访时间, 末次随访时间为2016-02-28或死亡、失访时间.
统计学处理 用SPSS16.0软件进行统计学处理, 近期疗效用χ2检验, 生存期采用Kaplan-Meier方法分析, Log-rank方法检验. 当P<0.05时, 差异有统计学意义.
患者均采用贝伐珠单抗联合化疗, 无失访患者. 全组贝伐珠单抗中位用药4.5 mo(0.75-12.00 mo). 首次联合化疗方案分别为: 以OXA为基础(FOLFOX、XELOX)的41例, 以CPT-11为基础(FOLFIRI、XELIRI)的26例, 采用单药Cape的4例. 一线治疗45例, 二线治疗24例, 三线治疗2例. 一线治疗中71.1%患者采用以OXA为基础化疗方案, 总治疗过程中位贝伐珠单抗用药6.0 mo; 二线治疗中62.5%患者采用以CPT-11为基础化疗方案, 总治疗过程中位贝伐珠单抗用药3.0 mo; 三线治疗患者均采用以OXA为基础化疗方案, 中位贝伐珠单抗用药1.5 mo. 患者治疗情况如表2.
| 线数 | OXA为主 | CPT-11为主 | Cape |
| 一线 | 32(71.1) | 11(24.4) | 2(4.4) |
| 二线 | 7(29.2) | 15(62.5) | 2(8.3) |
| 三线 | 2(100.0) | 0(0.0) | 0(0.0) |
全组患者后续治疗: 一线治疗45例患者中维持治疗者18例, 有41例患者进展, 1例患者死亡, 3例未进展; 二线治疗24例有22例进展, 2例未进展; 三线治疗2例患者均治疗后很快进展. 各线患者进展后的后续治疗如表3.
| 进展后的后续治疗 | n(%) |
| 一线 | |
| 贝伐珠单抗联合化疗 | 21(51.2) |
| 化疗 | 10(24.4) |
| 支持对症 | 10(24.4) |
| 二线 | |
| 贝伐珠单抗联合化疗 | 5(22.7) |
| 化疗 | 6(27.3) |
| 支持对症 | 11(50.0) |
| 三线 | |
| 支持对症 | 2(100.0) |
因三线患者仅2例, 分析时把二线和三线治疗合并为二线组. 全组患者RR为29.6%, DCR为78.9%; 一线治疗组RR为35.6%, DCR为88.9%. 二线治疗组RR为19.2%, DCR为61.5%. 一线与二线治疗组RR和DCR有统计学差异(P值分别为0.014, 0.007)(表4).
| 项目 | 一线组 | 二线组 | 合计 | P值 |
| 疗效 | ||||
| CR | 0 | 0 | 0 | |
| PR | 16 | 5 | 21 | |
| SD | 24 | 11 | 35 | |
| PD | 5 | 10 | 15 | |
| RR[n(%)] | 16(35.6) | 5(19.2) | 21(29.6) | 0.014 |
| DCR[n(%)] | 40(88.9) | 16(61.5) | 56(78.9) | 0.007 |
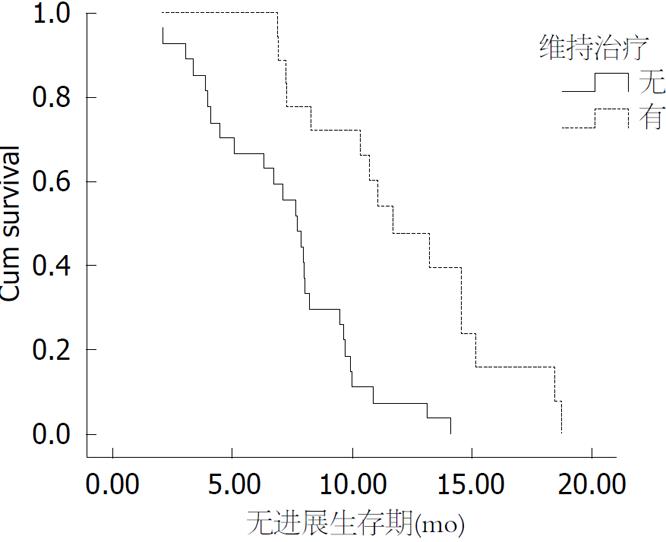
至随访结束(2016-02), 65例(91.5%)患者病变进展, 49例(69.0%)患者死亡. 中位的随访时间为14.9 mo(2.7-32.5 mo). 全组患者中位PFS(mPFS)和中位OS(mOS)分别为7.2 mo和19.0 mo. 一线治疗组患者mPFS和mOS分别为8.2 mo和20.9 mo. 二线治疗组患者的mPFS和mOS分别为4.4 mo和14.7 mo(表5). 一线化疗后维持治疗者18例, 接受维持治疗与未接受维持治疗的PFS分别为11.7 mo和7.7 mo(P<0.0001)(图1).
| 治疗 | mPFS | mOS |
| 全组 | 7.2(6.1-8.4) | 19.0(15.4-22.5) |
| 一线组 | 8.2(6.2-10.2) | 20.9(18.0-23.7) |
| 二线组 | 4.4(3.4-5.5) | 14.7(13.7-15.7) |
71例患者均可评价不良反应, 无治疗相关死亡. 大多数不良反应与使用化疗药物有关, 无治疗相关死亡. 化疗相关不良反应主要表现为恶心呕吐、骨髓抑制、腹泻、乏力、神经毒性、手足综合征等, 大多是1-2级; 3-4级毒性包括骨髓抑制9例(12.7%), 腹泻6例(8.5%), 神经毒性3例(4.2%), 手足综合征1例(1.4%). 应用贝伐珠单抗治疗相关的不良反应主要有高血压11例(15.5%)、蛋白尿8例(11.3%), 出血6例(8.5%), 心力衰竭1例(1.4%)等. 高血压3级毒性2例(在治疗多疗程后出现), 经服用降压药降至正常; 出血表现为便血、牙龈出血、鼻衄、月经期延长并增加, 均程度轻, 对症治疗缓解, 无需停药; 1例患者使用贝伐珠单抗第15次时出现双下肢水肿, 脑尿钠肽(BNP)3540 pg/mL, 诊断心衰, 停药后经对症处理BNP渐降至正常. 无动脉血栓、穿孔等发生(表6).
| 不良反应 | 1-2级 | 3级 | 4级 |
| 高血压 | 9 | 2 | 0 |
| 蛋白尿 | 8 | 0 | 0 |
| 出血 | 6 | 0 | 0 |
| 心力衰竭 | 1 | 0 | 0 |
决定患者预后的因素包括治疗效果、患者耐受性、治疗意愿等, 还有重要一点是经济状况. 贝伐珠单抗是医保外药物, 虽有慈善赠药, 仅少部分患者经济可承受. 新疆医科大学附属肿瘤医院使用贝伐珠单抗mCRC患者2012年12例, 2013年17例, 2014年23例, 2015-01/2015-07 19例. 本研究回顾性分析新疆医科大学附属肿瘤医院71例转移性结直肠癌患者应用贝伐珠单抗的疗效和安全性.
贝伐珠单抗与含氟尿嘧啶的标准一线治疗方案联用, 被证明使mCRC患者PFS及OS方面较单用化疗延长生存[4-6]. BEAT研究[11]表明贝伐珠单抗联合不同双药化疗方案(FOLFOX、XELOX、FOLFIRI)均使PFS和OS有一致生存获益. 我国学者研究亦表明一线贝伐珠单抗联合奥沙利铂为主方案(FOLFOX, XELOX)与联合伊立替康为主方案(FOLFIRI)的mPFS和mOS差异无统计学意义[12]. 在二线治疗中, ECOG3200研究表明在疾病进展后二线接受贝伐珠单抗联合化疗的mCRC患者比单纯化疗有效率高, PFS及OS延长[7]. ML18147研究显示一线贝伐珠单抗治疗后进展mCRC患者二线继续贝伐珠单抗联合化疗较单纯化疗延长mOS[8]. 以上临床研究表明贝伐珠单抗联合化疗在mCRC一线、二线、跨线使用均带来生存获益.
本研究mCRC患者贝伐珠单抗联合化疗包括多种以氟尿嘧啶为基础化疗方案, 其中一线组患者的mPFS和mOS分别为8.2 mo和20.9 mo, 患者生存与我国学者研究[13-15]结果相似, 并接近多个有关贝伐珠单抗关键RCT研究结果[4,5]. 可能与一线组化疗总中位使用贝伐珠单抗时间为6 mo有关. 二线组患者的mPFS和mOS分别为4.4 mo和14.7 mo, 二线患者mPFS与我国学者研究结果一致[14], 短于ECOG3200临床研究的mPFS[7], 分析原因: 二线患者中位贝伐珠单抗用药3.0 mo; 患者二线再进展后30%患者放弃继续治疗, 仅支持对症治疗. 全组病例mPFS是7.2 mo, mOS是19.0 mo, 考虑: 直肠癌占56.5%, 均是不可切除mCRC; 二线及三线患者占36.6%; 全组患者进展后放弃继续治疗占34.8%; 即使进展后继续化疗或联合靶向治疗也存在剂量不足、疗程不够等因素. 从本研究及既往研究来看一线使用贝伐珠单抗联合化疗较二线使用能够给mCRC患者带来更长生存, 同时足剂量、足疗程的治疗是患者生存获益的保障.
维持治疗是优化mCRC姑息治疗的重要策略和手段. CAIRO3研究[9]和AIO0207研究[10]表明一线贝伐珠单抗联合化疗后维持治疗显著改善生存, 都支持氟尿嘧啶联合贝伐珠单抗维持治疗.
2014年后新疆医科大学附属肿瘤医院疾病好转或稳定mCRC患者进行维持治疗. 本研究一线贝伐珠单抗联合化疗患者有18例(40%)病情好转或稳定后采用贝伐珠单抗联合单药氟嘧啶类药物进行维持治疗, 接受维持治疗与未接受维持治疗的mPFS分别为11.7 mo和7.7 mo(P<0.0001). 本组维持治疗患者PFS长于RCT研究结果[9,10], 可能原因是病例数较少, 存在偏倚. 本组中一线治疗维持治疗组18例患者中12例存活, 未维持治疗组23例患者仅1例患者存活, 维持治疗组OS尚未达到.
本研究中, 71例接受贝伐珠单抗联合化疗患者的RR为29.6%, DCR为78.9%; 一线组RR为35.6%, DCR为88.9%, 二线组RR为19.2%, DCR为61.5%, 与我国学者研究[12-15]结果一致, 可看出贝伐珠单抗联合化疗不论一线还是二线治疗优势在于疾病控制率高, 延缓病情发展.
贝伐珠单抗有关常见不良反应包括高血压、蛋白尿、出血, 少见的不良反应包括血栓栓塞、胃肠道穿孔、伤口愈合综合征、充血性心力衰竭等[16,17]. 本组患者与贝伐珠单抗相关的不良反应是高血压、出血、蛋白尿、心力衰竭等, 大多是1-2级, 耐受性好; 仅有2例3级毒性, 均是高血压, 经服用降压药降至正常; 1例心力衰竭患者在使用贝伐珠单抗第11次(维持治疗)时出现双下肢水肿, BNP 3540 pg/mL, 诊断心衰, 既往无高血压、冠心病史, 停药后经治疗BNP渐降至正常, 提示长疗程使用贝伐珠单抗需慎重. 我们在使用贝伐珠单抗时都是经过慎重选择患者, 对有胃肠道穿孔、感染、肠道明显出血、血栓栓塞、不可控制高血压等患者禁用, 对长疗程使用患者密切观察. 因此治疗前全面评估, 排除禁忌, 治疗中密切观察不良反应, mCRC患者应用贝伐珠单抗是安全的.
总之, 本研究表明mCRC患者一线使用贝伐珠单抗联合化疗能给mCRC患者带来更长生存, 足剂量、足疗程的治疗是患者生存获益的保障; 对治疗有效或稳定患者维持治疗可延缓病情进展. 本研究不良反应总体耐受性较好, 治疗前全面评估, 排除禁忌, 应用贝伐珠单抗是安全的. 今后需开展前瞻性临床研究明确贝伐珠单抗联合化疗的最佳方案和最适宜患者, 实现患者的个体化治疗.
贝伐珠单抗或西妥昔单抗联合标准化疗是转移性结直肠癌患者的标准治疗. 使用西妥昔单抗前必须检测K-ras基因状态, 而贝伐珠单抗疗效不受K-ras基因状态影响, 且价格更便宜, 患者经济承受力更高. 制定不可切除转移性结直肠癌(metastatic colorectal cancer, mCRC)患者靶向治疗决策时应综合考量疗效、安全性、经济等多种因素, 贝伐珠单抗联合各种化疗是mCRC治疗的优化选择.
张明鑫, 主治医师, 第四军医大学唐都医院消化内科
总体上来看, 靶向药物联合化疗治疗转移性结直肠癌患者得到了很大的改善, 生存期较前明显延长. 希望在今后的工作中能够明确贝伐珠单抗的疗效预测标志物和最适合化疗方案, 使得患者获益最大化, 真正实现肿瘤的个体化治疗.
基于大样本量的80405研究显示KRAS野生型的转移性结直肠患者一线治疗接受贝伐珠单抗或西妥昔单抗联用FOLFOX或FOLFIRI均达到了大约29 mo的OS获益. 因此两种药物均为一线治疗中合理的药物.
维持治疗是优化mCRC姑息治疗的重要策略和手段. 本研究一线贝伐珠单抗联合化疗患者病情好转或稳定后, 采用贝伐珠单抗联合单药氟嘧啶类药物接受维持治疗与未接受维持治疗的mPFS有明显提高(P<0.0001).
对转移性结直肠癌患者一线使用贝伐珠单抗联合化疗较二线能给患者带来更长生存; 对治疗有效或稳定患者维持治疗可延缓病情进展. 治疗前全面评估, 排除禁忌, 应用贝伐珠单抗是安全的.
维持治疗: 指在既定治疗周期后, 只停用某些可能导致毒性蓄积的药物, 并选择该方案内其他有效、低毒和使用方便的药物继续使用直至进展. 目的是采用合适的毒性更小的治疗方案而不降低治疗效果和患者生活质量.
回顾性分析了作者所在单位71例转移性结直肠癌患者应用贝伐珠单抗的疗效和安全性, 对于了解贝伐珠单抗在转移性结肠癌中的应用价值、患者筛选、临床疗效以及维持治疗的应用具有很强的参考价值.
编辑:于明茜 电编:都珍珍
| 2. | Heinemann V, von Weikersthal LF, Decker T, Kiani A, Vehling-Kaiser U, Al-Batran SE, Heintges T, Lerchenmüller C, Kahl C, Seipelt G. FOLFIRI plus cetuximab versus FOLFIRI plus bevacizumab as first-line treatment for patients with metastatic colorectal cancer (FIRE-3): a randomised, open-label, phase 3 trial. Lancet Oncol. 2014;15:1065-1075. [PubMed] [DOI] |
| 3. | Ellis LM, Hicklin DJ. VEGF-targeted therapy: mechanisms of anti-tumour activity. Nat Rev Cancer. 2008;8:579-591. [PubMed] [DOI] |
| 4. | Hurwitz H, Fehrenbacher L, Novotny W, Cartwright T, Hainsworth J, Heim W, Berlin J, Baron A, Griffing S, Holmgren E. Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. N Engl J Med. 2004;350:2335-2342. [PubMed] [DOI] |
| 5. | Saltz LB, Clarke S, Díaz-Rubio E, Scheithauer W, Figer A, Wong R, Koski S, Lichinitser M, Yang TS, Rivera F. Bevacizumab in combination with oxaliplatin-based chemotherapy as first-line therapy in metastatic colorectal cancer: a randomized phase III study. J Clin Oncol. 2008;26:2013-2019. [PubMed] [DOI] |
| 6. | Cunningham D, Lang I, Marcuello E, Lorusso V, Ocvirk J, Shin DB, Jonker D, Osborne S, Andre N, Waterkamp D. Bevacizumab plus capecitabine versus capecitabine alone in elderly patients with previously untreated metastatic colorectal cancer (AVEX): an open-label, randomised phase 3 trial. Lancet Oncol. 2013;14:1077-1085. [PubMed] [DOI] |
| 7. | Giantonio BJ, Catalano PJ, Meropol NJ, O'Dwyer PJ, Mitchell EP, Alberts SR, Schwartz MA, Benson AB. Bevacizumab in combination with oxaliplatin, fluorouracil, and leucovorin (FOLFOX4) for previously treated metastatic colorectal cancer: results from the Eastern Cooperative Oncology Group Study E3200. J Clin Oncol. 2007;25:1539-1544. [PubMed] [DOI] |
| 8. | Bennouna J, Sastre J, Arnold D, Österlund P, Greil R, Van Cutsem E, von Moos R, Viéitez JM, Bouché O, Borg C. Continuation of bevacizumab after first progression in metastatic colorectal cancer (ML18147): a randomised phase 3 trial. Lancet Oncol. 2013;14:29-37. [PubMed] [DOI] |
| 9. | Simkens LH, van Tinteren H, May A, ten Tije AJ, Creemers GJ, Loosveld OJ, de Jongh FE, Erdkamp FL, Erjavec Z, van der Torren AM. Maintenance treatment with capecitabine and bevacizumab in metastatic colorectal cancer (CAIRO3): a phase 3 randomised controlled trial of the Dutch Colorectal Cancer Group. Lancet. 2015;385:1843-1852. [PubMed] [DOI] |
| 10. | Hegewisch-Becker S, Graeven U, Lerchenmüller CA, Killing B, Depenbusch R, Steffens CC, Al-Batran SE, Lange T, Dietrich G, Stoehlmacher J. Maintenance strategies after first-line oxaliplatin plus fluoropyrimidine plus bevacizumab for patients with metastatic colorectal cancer (AIO 0207): a randomised, non-inferiority, open-label, phase 3 trial. Lancet Oncol. 2015;16:1355-1369. [PubMed] [DOI] |
| 11. | Van Cutsem E, Rivera F, Berry S, Kretzschmar A, Michael M, DiBartolomeo M, Mazier MA, Canon JL, Georgoulias V, Peeters M. Safety and efficacy of first-line bevacizumab with FOLFOX, XELOX, FOLFIRI and fluoropyrimidines in metastatic colorectal cancer: the BEAT study. Ann Oncol. 2009;20:1842-1847. [PubMed] [DOI] |
| 12. | Bai L, Zhang DS, Wu WJ, Ren C, Wang DS, Wang F, Qiu MZ, Xu RH. Clinical outcomes of Chinese patients with metastatic colorectal cancer receiving first-line bevacizumab-containing treatment. Med Oncol. 2015;32:469. [PubMed] [DOI] |
| 13. | 林 莉, 徐 建明, 王 岩, 葛 飞娇, 刘 烈军, 赵 传华, 李 珊珊, 刘 建芝, 李 志强. 贝伐单抗联合伊立替康为主方案一线治疗转移性结直肠癌的临床评价. 中华肿瘤杂志. 2010;32:786-790. |
| 14. | 郭 曦, 刘 天舒, 余 一祎, 周 宇红, 陈 勇, 庄 荣源, 崔 越宏. 贝伐珠单抗与化疗药物联合治疗转移性结直肠癌的近期疗效和安全性. 中华肿瘤杂志. 2013;35:604-607. |
| 15. | Guan ZZ, Xu JM, Luo RC, Feng FY, Wang LW, Shen L, Yu SY, Ba Y, Liang J, Wang D. Efficacy and safety of bevacizumab plus chemotherapy in Chinese patients with metastatic colorectal cancer: a randomized phase III ARTIST trial. Chin J Cancer. 2011;30:682-689. [PubMed] [DOI] |
| 16. | Gressett SM, Shah SR. Intricacies of bevacizumab-induced toxicities and their management. Ann Pharmacother. 2009;43:490-501. [PubMed] [DOI] |
| 17. | Hurwitz H, Saini S. Bevacizumab in the treatment of metastatic colorectal cancer: safety profile and management of adverse events. Semin Oncol. 2006;33:S26-S34. [PubMed] [DOI] |