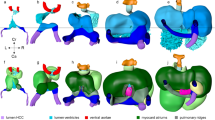
Summary
Most congenital cardiovascular malformations have their origins during early morphogenesis, and some forms of adult–onset cardiovascular disease also arise during embryonic development. Conotruncal heart defects comprise a major category of congenital heart disease and are found in children with a relative high frequency. These defects are associated with a high mortality risk in utero, and after postnatal surgical repair; embryologically they are linked with dextroposed aorta, which is an anomaly of the ventricular outflow tract with malalignment of the great arteries. The etiology and pathogenesis of dextroposed aorta is not known but is thought to be due to abnormal looping and/or incorrect “wedging” of the outflow tract (i.e., wedged positioning of the aorta between the atrioventricular valves) during early heart development. We have studied the morphology and visual development of the embryonic heart in an animal model of dextropsed aorta in a series of experiments to determine possible mechanisms for dextropositioning of the aorta. At this, we have employed besides established methods for analysis of anatomy and pathology (morphological studies, cardiac morphometry, histology, scanning electron microscopy and immunhistochemistry) also new imaging techniques (videocinephotography and time–lapse studies with a digital high–speed video camera, confocal and scanning electron microscopy, optical coherence tomography (OCT) and magnetic resonance microscopy (MRM) for 3D reconstruction of the heart) to achieve a better visualization of normal and pathological changes during heart development. The paper at hand summarizes the results of these studies.
Zusammenfassung.
Die meisten kongenitalen Anomalien des Herzens haben ihren Ursprung in und während der frühen Morphogenese, und selbst einige Herzerkrankungen, die erst im Erwachsenenalter auftreten, entstehen schon während der embryologischen Entwicklung des Herzens. Konotrunkale Herzfehler umfassen eine große Kategorie von angeborenen Defekten und kommen bei Kindern in relativ hoher Häufigkeit vor. Diese Herzfehler, die sowohl in utero als auch postnatal nach herzchirurgischen Eingriffen mit einem hohen Letalitätsrisiko einhergehen, sind entwicklungsgeschichtlich häufig mit Dextroposition der Aorta verbunden, welche sich in Anomalien des ventrikulären Ausflusstraktes in Form von Fehlausrichtung (Malalignment) der großen Gefäße wiederfindet. Die Ätiologie und Pathogenese der Mechanismen, die zu einer dextroponierten Aorta führen, sind nicht bekannt. Es wird aber angenommen, dass diese Fehlstellung auf eine gestörte Herzschleifenbildung und/oder fehlerhaftes „Wedging“ des Ausflusstraktes (d. h. Verkeilung der Aorta zwischen den Atrioventrikulärklappen) während der frühen Herzentwicklung zurückzuführen ist. Wir haben in einer Serie von Studien die Morphologie und visuelle Entwicklung des embryonalen Herzens in einem experimentellen Model von dextroponierter Aorta untersucht, um mögliche Mechanismen der Dextropostion der Aorta zu eruieren. Hierbei wurden neben zahlreichen etablierten Methoden zur Analyse der Anatomie und Pathologie (Morphologische Analysen, Kardiale Morphometrie, Histologie, Elektronenmikroskopie und Immunhistochemie) auch neue bildgebende Verfahren (Videocinephotographie und Zeitraffer–Studien mittels einer digitalen Hochgeschwindigkeitskamera, Konfokale und Raster–Elektronenmikroskopie, Optische Kohärenztomographie (OCT) und Magnetresonanzmikroskopie (MRM) zur 3–D–Rekonstruktion des Herzens) angewandt, um die normalen und pathologischen Veränderungen während der Herzentwicklung besser zu visualisieren. Die vorliegende Schrift fasst die Ergebnisse dieser Studien zusammen.
Similar content being viewed by others
References
Hoffman J (1995) Incidence of congenital heart disease. I: postnatal incidence. Pediatr Cardiol 16:103–113
Hoffman J (1995) Incidence of congenital heart disease. II: prenatal incidence. Pediatr Cardiol 16:155–165
Dees E, Lin H, Cotton RB et al. (2000) Outcome of preterm infants with congenital heart disease. J Pediatr 137:653–659
Lutin WA, Brumund MR, Jones C et al (1999) Hemodynamic abnormalities in fetuses with congenital heart disease. Pediatr Cardiol 20:390–395
Moller JH (1998) Surgery of congenital heart disease: pediatric cardiac care consortium 1984–1995. Perspectives in Pediatric Cardiology. Vol 6. Futura Publishing, New York, NY
Jenkins KJ, Gauvreau K, Newburger JW et al. (2002) Consensus-based method for risk adjustment for surgery for congenital heart disease. J Thorac Cardiovasc Surg 123:110–118
Lenfant C (2002) Report of the task force on research in pediatric cardiovascular disease. Circulation 106(9):1037–1042
National Heart, Lung, and Blood Institute Task Force Report on Research in Pediatric Cardiovascular Disease (2002) http://www.nhlbi.nih.gov/resources/ docs/pediatric_cvd.htm.
De la Cruz MV, Markwald RR (eds) (1998) Living morphogenesis of the heart. Birkhäuser, Boston, Mass
Harvey RP, Rosenthal N (eds) (1999) Heart development. Academic Press, London, UK
Tomanek RJ, Runyan RB (eds) (2001) Formation of the heart and its regulation (cardiovascular molecular morphogenesis). Birkhäuser, Boston, Mass
Bartelings MM, Gittenberger-de Groot AC (1989) The outflow tract of the heart: embryologic and morphologic correlations. Int J Cardiol 22:289–300
Leatherbury L, Waldo K (1995) Visual understanding of cardiac development: the neural crest’s contribution. Cell Mol Biol Res 41:279–291
Kirby ML (1999) Contributions of neural crest to heart and vessel morphology. In: Harvey RP, Rosenthal N (eds) Heart Development. Academic Press, Boston, Mass 179–193
Hamburger V, Hamilton HL (1951) A series of normal stages in the development of the chick embryo. J Morphol 88:49–92
Kirby ML (1997) The heart. In: Thorogood P (eds) Embryos, genes and birth defects. John Wiley & Sons Ltd
Farrell MJ, Stadt H, Wallis KT et al. (1999) HIRA, a DiGeorge syndrome candidate gene, is required for cardiac outflow tract septation. Circ Res 84:127–135
Yelbuz TM, Waldo KL, Kumiski DH et al. (2002) Shortened outflow tract leads to altered cardiac looping after neural crest ablation. Circulation 106:504–510
Yasui H, Morishima M, Nakazawa M et al. (1999) Developmental spectrum of cardiac outflow tract anomalies encompassing transposition of the great arteries and dextroposition of the aorta: pathogenic effect of extrinsic retinoic acid in the mouse embryo. Anat Rec 254:253–260
Waldo KL, Kumiski DH, Wallis KT et al. (2001) Conotruncal myocardium arises from a secondary heart field. Development 128:3179–3188
Kelly RG, Brown NA, Buckingham ME (2001) The arterial pole of the mouse heart forms from Fgf10-expressing cells in pharyngeal mesoderm. Dev Cell 1:435–440
Mjaatvedt CH, Nakaoka T, Moreno- Rodriguez R et al. (2001) The outflow tract of the heart is recruited from a novel heart-forming field. Dev Biol 238:97–109
Yelbuz TM, Waldo KL, Zhang X et al. (2003) Myocardial volume and organization are changed by failure of addition of secondary heart field myocardium to the cardiac outflow tract. Developmental Dynamics 228:152–160
Zhang X, Yelbuz TM, Cofer GP et al. (2003) Improved preparation of chick embryonic samples for magnetic resonance microscopy. Magnetic Resonance in Medicine 49:1192–1195
Yelbuz TM, Zhang X, Choma MA et al. (2003) Approaching cardiac development in 3D by Magnetic Resonance Microscopy (MRM). Circulation 108:e154–e155
Yelbuz TM, Choma MA, Thrane L et al. (2002) Optical coherence tomography – a new high-resolution imaging. Technology to Study Cardiac Development in Chick Embryos. Circulation 106:2771–2774
Yelbuz TM, Leatherbury L, Wolfe RR et al. (2002) Time-lapse study with high speed video camera in the early embryonic chick heart to visualize a time window of normal and abnormal heart development. Circulation 106:e44–e45
Author information
Authors and Affiliations
Corresponding author
Additional information
Unterstützt durch folgende Stipendien: NIH grants HL36059 und HD17036 (M. L. Kirby); Deutsche Herzstiftung, Deutsche Forschungsgemeinschaft und Postdoctoral Fellowship Grant der American Heart Association, Georgia Affiliate (T.M. Yelbuz).
Diese Arbeit ist die gekürzte und modifizierte Version einer Übersichtsarbeit, für die am 7. Oktober 2003 auf der 35. Jahrestagung der Deutschen Gesellschaft für Pädiatrische Kardiologie in Weimar (4.–7. Okt. 2003) der Forschungspreis 2003 der Deutschen Gesellschaft für Pädiatrische Kardiologie vergeben wurde.
Rights and permissions
About this article
Cite this article
Yelbuz, T.M., Wessel, A. & Kirby, M.L. Studien zur Morphogenese und Visualisierung des frühen embryonalen Herzens im Hinblick auf die Entwicklung konotrunkaler Herzfehler. Z Kardiol 93, 583–594 (2004). https://doi.org/10.1007/s00392-004-0107-z
Received:
Accepted:
Issue Date:
DOI: https://doi.org/10.1007/s00392-004-0107-z
Key words
- Heart development
- conotruncal heart defects
- imaging of the embryonic heart
- optical coherence tomography (OCT)
- magnetic resonance microscopy (MRM)