Abstract
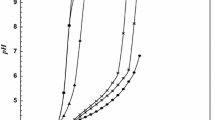
Ternary complexes of Co(II), Ni(II) and Cu(II) with pyridine (Py) or 2-methyl pyridine (2-MePy) (primary ligand) and some phenoxyacetic acid herbicides, such as phenoxyacetic acid (PAA), 2-chlorophenoxyacetic acid (2-CPA), 2,4-dichlorophenoxyacetic acid (2,4-D) and 2,4,5-trichlorophenoxyacetic acid (2,4,5-T) (secondary ligands) have been studied in solution using a potentiometricpH-titration technique in order to test a complexation hypothesis of plant growth regulating activities of these herbicides. From stability constant data, the species distribution have been computed and it was found that the percentage of ternary complex (MAL) is about 60% of the totalM 2+ present at highpH indicating greater stability of these ternary complexes. TheMA + species (M 2+-Py andM 2+-2-MePy) have shown discriminating behaviour towards the next incoming secondary ligand containing O as donor atoms. Since the stabilities of biologically active (2-CPA, 2,4-D and2,4,5-T) and inactive (PAA) phenoxyacetic acid herbicides in binary (ML 2) and ternary (MAL) metal complexes were found approximately of the same magnitude, chelation may not thus be the probable mode of action of these plant growth regulators.
Zusammenfassung
Ternäre Komplexe von Co(II), Ni(II) und Cu(II) mit Pyridin (Py) oder 2-Methylpyridin (2-Me Py) als Primärliganden und einigen Herbiziden vom Phenoxyessigsäure-Typ [Phenoxyessigsäure (PAA), 2-Chlor-PAA (2-CPA), 2,4-Dichlor-PAA (2,4-D) und 2,4,5-Trichlor-PAA (2,4,5-T)] als Sekundärliganden wurden im Hinblick auf eine Komplexierungshypothese der pflanzenwuchssteuernden Wirkung dieser Herbizide mittels potentiometrischerpH-Titration untersucht. Aus den Stabilitätskonstanten wurden die Anteile der einzelnen Spezien in Lösung berechnet. Dabei wurden 60% an ternärem Komplex (MAL) — bezogen auf die totaleM 2−-Menge — bei hohenpH-Werten festgestellt und damit die größere Stabilität dieser Komplexe gezeigt. DieMA +-Spezies (M 2+-Py undM 2+-MePy) zeigte ein unterschiedliches Verhalten gegenüber dem nächsten chelierenden Liganden mit O als Donor. Da die Stabilitäten der biologisch aktiven (2-CPA, 2,4-D und2,4,5,-T) und inaktiven (PAA) Liganden in binären (ML 2) und ternären (MAL) Metallkomplexen in der gleichen Größenordnung liegen, scheint die Komplexierung bei der Regulierung des Pflanzenwuchses bei diesen Herbiziden kein entscheidender Faktor zu sein.
Similar content being viewed by others
References
Sahai R., Kushwaha S. S. S., Chaudhary A. K., J. Ind. Chem. Soc.57, 844 (1980).
Sigel H., ed., Metal Ions in Biological System. New York: Marcel Dekker. 1973.
Koelsch C. F., J. Amer. Chem. Soc.53, 304 (1931).
Vogel A. I., A Text Book of Practical Organic Chemistry, 3rd ed. London: Longmans. 1959.
Vogel A. I., Quantitative Inorganic Analysis, 3rd ed. London: Longmans. 1961.
Martell A. E., Smith R. M., eds., Stability Constants of Metal-Ion Complexes, Supplement No. 1. London: The Chemical Society. 1971.
Chabereck Jr., Martell A. E., J. Amer. Chem. Soc.73, 5052 (1952).
Heureux G. A. L., Martell A. E., J. Inorg. Nucl. Chem.28, 481 (1966).
Sigel H., Chimia (Aarau)21, 489 (1967).
Sigel H., Becker K., McCormick D. B., Biochim. Biophys. Acta148, 655 (1967).
Grieser R., Prijis B., Sigel H., Inorg. Nucl. Chem. Letters4, 137 (1968).
Sigel H., Angew. Chem. Int. Eng. Ed.14, 394 (1975).
Sigel H., Caraco R., Prijis B., Inorg. Chem.13, 462 (1962).
Griesser R., Sigel H., Inorg. Chem.2, 1238 (1970).
Irving H., Williams R. J. P., Nature162, 746 (1948).
Nakamota K., Infrared Spectra of Inorganic and Coordination Compounds. New York: John Wiley. 1963.
Nelson S. M., Sephered T. M., Inorg. Chem.4, 813 (1965).
Sigel H., Hubber P. R., Pasternack R. F., Inorg. Chem.10, 2226 (1971).
Prout C. K.,Armstrong R. A.,Carruthers J. B.,Forrest J. C.,Murray-Rust P.,Rossotti F. J. C., J. Chem. Soc.A 1968, 2791.
Curran Sr. M. D., Glonck C., Quagliano J. V., J. Amer. Chem. Soc.84, 2014 (1962).
Author information
Authors and Affiliations
Rights and permissions
About this article
Cite this article
Sahai, R., Chaudhary, A.K. Ternary complexes of some phenoxyacetic acid herbicides and pyridines with metal ions of biological interest. Monatsh Chem 113, 681–689 (1982). https://doi.org/10.1007/BF00809006
Received:
Accepted:
Issue Date:
DOI: https://doi.org/10.1007/BF00809006