Abstract
Little is known about the bionomics of solitary, ground-nesting bees. We established a population of the oil bee, Macropis fulvipes, in a flight cage and recorded the emergence phenology, sex ratio, nesting behavior, and foraging behavior of individually marked bees. The population was protandrous and the sex ratio was balanced in three of the four observation years. The date of first emergence varied even though the sum of temperatures before emergence was similar across years. Adults of both sexes fed on the pollen of Lysimachia punctata host plants. Females additionally visited flowers to collect oil for the nest-cell lining, as well as oil and pollen for larval provisions. Duration of collecting trips, flower visits, and nest stays were influenced by the reward collected. Bees required 12 collecting trips and 460 visitations to flowers to complete a single cell. Therefore, to sustain a viable population of 50–500 individuals, 20,000–200,000 flowers are required. Our study shows that observations in a closed system can provide new insights into the bionomics of bees.





Similar content being viewed by others
References
Aguiar, C.M.L., Gaglianone, M.C. (2003) Nesting biology of Centris (Centris aenea) Lepeletier (Hymenoptera, Apidae, Centridini). Rev. Bras. Zool. 20, 601–606
Aguiar, C.M.L., Garófalo, C.A. (2004) Nesting biology of Centris (Hemisiella) tarsata Smith (Hymenoptera, Apidae, Centridini). Rev. Bras. Zool. 21, 477–486
Albans, K.R., Aplin, R.T., Brehcist, J., Moore, J.F., O’Toole, C. (1980) Dufour's gland and its role in secretion of nest cell lining in bees of the genus Colletes (Hymenoptera: Colletidae). J. Chem. Ecol. 6, 549–564
Alves-Dos-Santos, I., Melo, G.A.R., Rozen, J.G. (2002) Biology and immature stages of the bee tribe Tetrapediini (Hymenoptera: Apidae). Am. Mus. Novit. 3377, 1–45
Alves-Dos-Santos, I., Naxara, S.R.C., Patrício, E.F.L.R.A. (2006) Notes on the morphology of Tetrapedia diversipes KLUG 1810 (Tetrapediini, Apidae), an oil collecting bee. Braz. J. Morphol. Sci. 23, 425–430
Batra, S.W.T. (1995) Bees and pollination in our changing environment. Apidologie 26, 361–370
Biesmeijer, J.C., Roberts, S.P.M., Reemer, M., Ohlemuller, R., Edwards, M., Peeters, T., Schaffers, A.P., Potts, S.G., Kleukers, R., Thomas, C.D., Settele, J., Kunin, W.E. (2006) Parallel declines in pollinators and insect-pollinated plants in Britain and the Netherlands. Science 313, 351–354
Bosch, J. (2008) Production of undersized offspring in a solitary bee. Anim. Behav. 75, 809–816
Bosch, J., Kemp, W.P. (2004) Effect of pre-wintering and wintering temperature regimes on weight loss, survival, and emergence time in the mason bee Osmia cornuta (Hymenoptera: Megachilidae). Apidologie 35, 469–479
Buchmann, S.L. (1987) The ecology of oil flowers and their bees. Annu. Rev. Ecol. Syst. 18, 343–369
Camillo, E. (2004) Nesting biology of four Tetrapedia species in trap-nests (Hymenoptera: Apidae: Tetrapediini). Rev. Biol. Trop. 53, 175–186
Cane, J.H. (1981) Dufour's gland secretion in the cell linings of bees (Hymenoptera: Apoidea). J. Chem. Ecol. 7, 403–410
Cane, J.H., Eickwort, G.C., Wesley, F.R., Spielholz, J. (1983a) Foraging, grooming, and mating behaviors of Macropis nuda (Hymenoptera: Melittidae) and use of Lysimachia ciliata (Primulaceae) oils in larval provisions and cell lining. Am. Midl. Nat. 110, 257–264
Cane, J.H., Gerdin, S., Wife, G. (1983b) Mandibular gland secretions of solitary bees (Hymenoptera, Apoidea)—potential for nest cell disinfection. J. Kans. Entomol. Soc. 56, 199–204
Celary, W. (2004) A comparative study on the biology of Macropis fulvipes (Fabricius, 1804) and Macropis europaea Warncke 1973 (Hymenoptera: Apoidea: Melittidae). Folia. Biol. Krak. 52, 81–85
Cocucci, A.A. (1991) Pollination biology of Nierembergia (Solanaceae). Pl. Syst. Evol. 174, 17–35
Cocucci, A.A., Vogel, S. (2001) Oil-producing flowers of Sisyrinchium species (Iridaceae) and their pollinators in southern South America. Flora 196, 26–46
Colonello, N.A., Hartfelder, K. (2005) She’s my girl—male accessory gland products and their function in the reproductive biology of social bees. Apidologie 36, 231–244
Cox-Foster, D.L., Conlan, S., Holmes, E.C., Palacios, G., Evans, J.D., Moran, N.A., Quan, P.L., Briese, T., Hornig, M., Geiser, D.M., Martinson, V., van Engelsdorp, D., Kalkstein, A.L., Drysdale, A., Hui, J., Zhai, J., Cui, L., Hutchison, S.K., Simons, J.F., Egholm, M., Pettis, J.S., Lipkin, W.I. (2007) A metagenomic survey of microbes in honey bee colony collapse disorder. Science 318, 283–287
Danforth, B.N. (1990) Provisioning behavior and the estimation of investment ratios in a solitary bee, Calliopsis (Hypomacrotera) persimilis (Cockerell) (Hymenoptera: Andrenidae). Behav. Ecol. Sociobiol. 27, 159–168
Danks, H.V. (2007) The elements of seasonal adaptations in insects. Can. Entomol. 139, 1–44
Dötterl, S., Schäffler, I. (2007) Flower scent of floral oil-producing Lysimachia punctata as attractant for the oil bee Macropis fulvipes. J. Chem. Ecol. 33, 441–445
Galán, C., Cariñanos, P., García-Mozo, H., Alcázar, P., Domínguez-Vilches, E. (2001) Model for forecasting Olea europaea L. airborne pollen in South-West Andalusia, Spain. Int. J. Biometeorol 45, 59–63
Goubara, M., Takasaki, T. (2003) Flower visitors of lettuce under field and enclosure conditions. Appl. Entomol. Zool. 38, 571–581
Hefetz, A., Fales, H.M. (1979) Natural polyesters: Dufour’s gland macrocyclic lactones form brood cell laminesters in Colletes bees. Science 204, 415–417
Hoover, S.E.R., Higo, H.A., Winston, M.L. (2006) Worker honey bee ovary development: seasonal variation and the influence of larval and adult nutrition. J Comp Physiol B 176, 55–63
Jesus, B.M.V., Garófalo, C.A. (2000) Nesting behaviour of Centris (Heterocentris) analis (Fabricius) in southeastern Brazil (Hymenoptera, Apidae, Centridini). Apidologie 31, 503–515
Kearns, C.A., Inouye, D.W. (1997) Pollinators, flowering plants, and conservation biology. Bioscience 47, 297–307
Kearns, C.A., Inouye, D.W., Waser, N.M. (1998) Endangered mutualisms: the conservation of plant–pollinator interactions. Ann. Rev. Ecolog. Syst. 29, 83–112
Kevan, P.G. (1999) Pollinators as bioindicators of the state of the environment: species, activity and diversity. Agric. Ecosyst. Environ. 74, 373–393
Kevan, P.G., Phillips, T.P. (2001) The economic impacts of pollinator declines: an approach to assessing the consequences. Conserv Ecol 5, 8
Klein, A.M., Vaissière, B.E., Cane, J.H., Steffan-Dewenter, I., Cunningham, S.A., Kremen, C., Tscharntke, T. (2007) Importance of pollinators in changing landscapes of world crops. Proc. Roy. Soc. B. Biol. Sci. 274, 303–313
Kim, J.Y. (1999) Influence of resource level on maternal investment in a leaf-cutter bee (Hymenoptera: Megachilidae). Behav. Ecol. 10, 552–556
Laaidi, M. (2001) Forecasting the start of the pollen season of Poaceae: evaluation of some methods based on meteorological factors. Int. J. Biometeorol 45, 1–7
Linsley, E.G. (1958) The ecology of solitary bees. Hilgardia 27, 543–599
Malyshev, S.I. (1929) The nesting habits of Macropis Pz. (Hym. Apoidea). Eos. 5, 97–109
Michener, C.D. (2007) The bees of the world. The John Hopkins University Press, Baltimore
Michez, D., Patiny, S. (2005) World revision of the oil collecting bee genus Macropis Panzer 1809 (Hymenoptera: Apoidea: Melittidae) with a description of a new speciesfrom Laos. Ann. Soc. Entomol. Fr. 41, 15–28
Minckley, R.L., Wcislo, W.T., Yanega, D.A., Buchmann, S.L. (1994) Behavior and phenology of a specialist bee (Dieunomia) and sunflower (Helianthus) pollen availability. Ecology 75, 1406–1419
Minckley, R.L., Roulston, T.H. (2006) Incidental mutualisms and pollen specialization among bees. In: Waser, N.M., Ollerton, J. (eds.) Specialization and generalization in plant–pollinator interactions, pp. 69–98. The University of Chicago Press, Chicago
Mouradov, A., Cremer, F., Coupland, G. (2002) Control of flowering time: interacting pathways as a basis for diversity. Plant Cell. 14, 111–130
Müller, A., Diener, S., Schnyder, S., Stutz, K., Sedivy, C., Dorn, S. (2006) Quantitative pollen requirements of solitary bees: implications for bee conservation and the evolution of bee–flower relationships. Biol. Conserv. 130, 604–615
Murray, T.E., Kuhlmann, M., Potts, S.G. (2009) Conservation ecology of bees: populations, species and communities. Apidologie 40, 211–236
Neff, J.L. (2008) Components of nest provisioning behavior in solitary bees (Hymenoptera: Apoidea). Apidologie 39, 30–45
Neff, J.L., Simpson, B.B. (2005) Rewards in flowers. Other rewards: oils, resins, and gums. In: Dafni, A., Kevan, P.G., Husband, B.C. (eds.) Practical Pollination Biology, pp. 314–328. Enviroquest, Ltd., Cambridge
Nietschke, B.S., Magarey, R.D., Borchert, D.M., Calvin, D.D., Jones, E. (2007) A developmental database to support insect phenology models. Crop. Prot. 26, 1444–1448
Rasmussen, C. (1999) Coevolution of the oil bee-Calceolaria system in the Andes of Peru. M.Sc. thesis, University of Aarhus, Denmark. Available at: http://science.melipona.org/PDF/MSc%20thesis%20%281999%29.pdf
Renner, S.S., Schäfer, H. (2010) The evolution and loss of oil-offering flowers: new insights from dated phylogenies for angiosperms and bees. Philos. T. Roy. Soc. B 365, 423–435
Reeves, P.H., Coupland, G. (2000) Response of plant development to environment: control of flowering by daylength and temperature. Curr. Opin. Plant Biol. 3, 37–42
Rozen, J.G., Buchmann, S.L. (1990) Nesting biology and immature stages of bees Centris caesalpinae, C. pallida, and the cleptoparasite Ericrocis lata (Hymenoptera: Apoidea: Anthophoridae). Am. Mus. Novit. 2985, 1–30
Schäfer, M.O., Dietemann, V., Pirk, C.W.W., Neumann, P., Crewe, R.M., Hepburn, H.R., Tautz, J., Crailsheim, K. (2006) Individual versus social pathway to honeybee worker reproduction (Apis mellifera): pollen or jelly as protein source for oogenesis? J. Comp. Physiol. A 192, 761–768
Schindler, M. (2004) Biologie kleptoparasitischer Bienen und ihrer Wirte (Hymenoptera, Apiformes). Labor- und Freilanduntersuchungen an Arten der Gattungen Nomada und Andrena, Dissertation, Rheinische Friedrich-Wilhelms-Universität, Bonn
Schlindwein, C., Wittmann, D., Martins, C.F., Hamm, A., Siqueira, J.A., Schiffler, D., Machado, I.C. (2005) Pollination of Campanula rapunculus L. (Campanulaceae): how much pollen flows into pollination and into reproduction of oligolectic pollinators? Plant. Syst. Evol. 250, 147–156
Sérsic, A.N. (2004) Pollination biology in the genus Calceolaria (Calceolariaceae), Stapfia 82, 1–121
Shaffer, M.L. (1981) Minimum population sizes for species conservation. Bioscience 31, 131–134
Simpson, B.B., Neff, J.L. (1981) Floral rewards: alternatives to pollen and nectar. Ann Mo Bot Gard 68, 301–22
StatSoft, Inc. (2004) STATISTICA (data analysis software system), version 7. Available at: www.statsoft.com
Steffan-Dewenter, I., Potts, S.G., Packer, L. (2005) Pollinator diversity and crop pollination services are at risk. Trends. Ecol. Evol. 20, 651–652
Stephen, W.P. (1965) Temperature effects on the development and multiple generations in the alkali bee, Nomia melanderi Cockerel. Entomol. Exp. Appl. 8, 228–240
Stephen, W.P., Bohart, G.E., Torchio, P.F. (1969) The biology and external morphology of bees; with a synopsis of the genera of northwestern America, Corvallis. Agricultural Experiment Station, Oregon State University, Oregon
Vinson, S.B., Frankie, G.W. (1988) A comparative study of the ground nests of Centris flavifrons and Centris aethiocesta (Hymenoptera: Anthophoridae). Entomol. Exp. Appl. 49, 181–187
Vogel, S. (1974) Ölblumen und ölsammelnde Bienen, Trop. u. subtrop. Pflanzenwelt 7, 1–267
Vogel, S. (1976) Lysimachia: Ölblumen der Holarktis. Naturwissenschaften 63, 44
Vogel, S. (1986) Ölblumen und ölsammelnde Bienen, Zweite Folge: Lysimachia und Macropis Trop. u. subtrop. Pflanzenwelt 54, 1–168
Vogel, S. (1989) Fettes Öl als Lockmittel- Erforschung der ölbietenden Blumen und ihrer Bestäuber, in: Akademie der Wissenschaften und der Literatur Mainz, Jubiläumsband, Franz Steiner Verlag, Stuttgart. pp 113–130
Westrich, P. (1990) Die Wildbienen Baden-Württembergs, 2 Aufl. Ulmer Verlag, Band II
Wielgolaski, F.E. (1999) Starting dates and basic temperatures in phenological observations of plants. Int. J. Biometeorol. 42, 158–168
Wiklund, C., Fagerström, T. (1977) Why do males emerge before females—hypothesis to explain incidence of protandry in butterflies. Oecologia 31, 153–158
Acknowledgments
We are grateful to Gregor Aas for providing the greenhouse for the flight cage, the gardeners of the Ecological Botanical Garden (EBG) of the University of Bayreuth for making Lysimachia plants available, Bernhard Liedl for providing the flexible endoscope, and to Kathrin Milchreit for providing a photograph. Temperature data from the EBG were kindly provided by the Department of Micrometeorology, University of Bayreuth. Thomas Foken helped to calculate temperature sums. Andrea Cocucci and Kim Steiner as well as two anonymous referees gave valuable comments on earlier versions of the manuscript.
Une journée dans la vie d’une abeille récolteuse d’huile: phénologie, comportement de nidification et d’approvisionnement.
Macropis fulvipes / somme des températures / abeille solitaire / Lysimachia / plante hôte / comportement de ponte / comportement d’approvisionnement
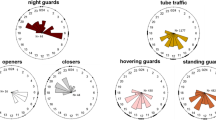
Zusammenfassung – Ein Tag im Leben einer Ölbiene: Phänologie, Nestbau- und Verproviantierungsverhalten. Bienen sind die wichtigsten Bestäuber vieler Kultur- sowie Wildpflanzen (Klein et al. 2007; Michener 2007). Der Verlust von Lebensräumen bedingt durch die Veränderung von Landschaften führte zu einer Abnahme der Bienen in den letzten Jahrzehnten (Kearns and Inouye 1997; Murray et al. 2009). Um Bienen langfristig schützen zu können, ist es wichtig, deren Biologie und besonders deren Habitatansprüche (z. B. Anzahl benötigter Blüten, Niststandorte) zu kennen. Die vorliegende Arbeit befasst sich mit der Bionomie der im Boden nistenden und solitär lebenden Schenkelbiene Macropis fulvipes, die wir vier Jahre lang in einem Flugkäfig untersuchten. M. fulvipes ist auf das Blütenöl und den Pollen des Gilbweiderichs (Lysimachia spp.) spezialisiert. Das Blütenöl wird benutzt, um einzelne Brutzellen auszukleiden und zusammen mit Pollen dient es als Larvenfutter. Im ersten Beobachtungsjahr schlüpften die Bienen zwischen Mitte und Ende Juni, und damit ungefähr einen Monat später als in den darauffolgenden Jahren (Tab. I), wobei die Schlüpfzeit immer mit der Blütezeit der Wirtspflanze korrelierte. Möglicherweise waren Temperaturunterschiede zwischen den Jahren für diese Unterschiede in der Phänologie verantwortlich (Galán et al. 2001). In drei der vier Jahre erschienen die Männchen früher als die Weibchen. Bis auf ein Jahr, in dem mehr Weibchen als Männchen schlüpften, war das Geschlechterverhältnis ausgeglichen (Abb. 1; Tab. I). Nach dem Schlüpfen besuchten männliche sowie weibliche Bienen Blüten von L. punctata, um Pollen zu fressen (Abb. 2a, b). Proteine sind bei weiblichen Bienen für das Reifen der Eier wichtig (z.B. Hoover et al. 2006) und auch bei Männchen könnten sie einen Einfluss auf die Fertilität haben (Colonello and Hartfelder 2005). Die Weibchen begannen zwei bis drei Tage nach dem Fressen von Pollen und dem Graben eines Nestes, Blütenprodukte zu sammeln. Zuerst wurde Öl von L. punctata Blüten gesammelt (hauptsächlich morgens und am frühen Nachmittag, Abb. 3 and 4), um damit die Brutzellen auszukleiden. Danach besuchten sie die Blüten, um gleichzeitig Öl und Pollen als Larvenfutter zu sammeln. Einzelne Öl-Sammelflüge dauerten 5 Minuten, für einen Öl + Pollen-Sammelflug benötigten die Weibchen die doppelte Zeit (Abb. 5a). Während eines Öl-Sammelflugs besuchten sie 16 Blüten. Vier bis fünf solcher Flüge waren für die Auskleidung einer Brutzelle nötig. Während eines Öl + Pollen-Sammelfluges besuchten die Weibchen 66 Blüten. Sieben solcher Sammelflüge waren nötig, um eine Brutzelle zu verproviantieren. Das Sammeln von Öl dauerte elf Sekunden pro Blütenbesuch, das Sammeln von Öl + Pollen nur die Hälfte dieser Zeit. Daraus lässt sich folgern, dass die Blüten verhältnismäßig viel Öl im Vergleich zu Pollen produzieren und das Öl zu Pollen Verhältnis des Larvenfutters nicht dem Öl zu Pollen Verhältnis in einer Blüte gleicht. Nach einem Öl-Sammelflug verblieben die Weibchen für sieben Minuten im Nest, nach einem Öl + Pollen-Sammelflug drei Minuten. Die Bienen benötigten 1 h, um Öl zu sammeln und die Zelle auszukleiden, 1,5 h, um Öl + Pollen zu sammeln und die Brutzelle zu verproviantieren. Sie besuchten ca. 460 Blüten, um eine Zelle fertig zu stellen. Bei guten Witterungsbedingungen stellten die Bienen zwei Zellen pro Tag fertig. Zum einen gibt unsere Studie einen neuen Einblick in das Verhalten einer Ölbiene und zum anderen zeigt sie, dass Beobachtungen von solitären Bienen in einem Flugkäfig hilfreich sind, um mehr über deren Lebensweise und deren Ansprüche zu erfahren (Goubara and Takasaki 2003; Schindler 2004).
Macropis fulvipes / Ölbiene / Temperatursumme / Solitärbiene / Bedarf an Lysimachia Wirtspflanzen / Nestbau- und Verproviantierungsverhalten
Author information
Authors and Affiliations
Corresponding author
Additional information
Manuscript editor: Marla Spivak
Rights and permissions
About this article
Cite this article
Schäffler, I., Dötterl, S. A day in the life of an oil bee: phenology, nesting, and foraging behavior. Apidologie 42, 409–424 (2011). https://doi.org/10.1007/s13592-011-0010-3
Received:
Revised:
Accepted:
Published:
Issue Date:
DOI: https://doi.org/10.1007/s13592-011-0010-3